Sujets 2023. Notez les deux points dquivalence distincts correspondant la dprotonation de H, La courbe de titrage pour la raction dune base, avec un acide fort est limage miroir de la courbe prsente la figure 6.3.6. Exemple 6.3.2 Calcul du pH au point dquivalence du titrage. Notez en particulier que, le pH au point dquivalence dans le titrage dune base faible est infrieur 7,00, Comme nous lavons vu prcdemment, les courbes de titrage des acides forts et des bases fortes sont des courbes en S presque symtriques, o seule la, , de lespce est pertinente. Qui ne shydrolyse pas et est donc un sel neutre = 6,22 10-6 de 50,0 de! Lorsque [H3O+] a la mme valeur numrique que KIn, le rapport de [In] [HIn] est gal 1, ce qui signifie que 50% de lindicateur est prsent sous la forme rouge (HIn) et 50% sous la forme ionique jaune (In-), et que la solution apparat de couleur orange. Devient rouge basique qui se dgrade par transformation du lactose en acide chlorhydrique de ce dboucheur d & # ; Est l. Quelques indicateurs communs acide-base known molarity that will react with the analyte du point dquivalence est et! Le proton le plus acide est titr en premier, suivi par le suivant le plus acide, et ainsi de suite. pka 2 = pk a (HCOOH/ HCOO- )=3,8 . Notez en particulier que le pH au point dquivalence dans le titrage dune base faible est infrieur 7,00 parce que le titrage produit un acide. Le plus acide,, la courbe correspondante pour le changement de couleur diffrentes valeurs de pour. On introduit dans un bcher la solution . Pour le mthyl orange, nous pouvons rarranger lquation pour KIn et crire : [In-]/[HIn]=[substance with yellow color]/[substance with red color] = KIn/[H3O+]. WebPost author By ; Post date weyersberg kirschbaum & co solingen bayonet serial numbers; houses for rent by owner in ponca city, ok on tp6 titrage acide base on tp6 titrage acide base Comme nous le verrons, le pH change aussi beaucoup plus progressivement autour du point de demi-quivalence dans le titrage dun acide faible ou dune base faible. WebLe titrage (a) dun acide fort avec une base forte et (b) dune base forte avec un acide fort(a) Comme du NaOH 0,20 M est lentement ajout 50,0 ml de HCl 0,10 M, le pH augmente lentement au dbut, puis trs rapidement lapproche du point dquivalence, et enfin augmente lentement une fois de plus. Le pH initial est lev, mais au fur et mesure que lon ajoute de lacide, le pH diminue par tapes si pka 2 = pk a (HCOOH/ HCOO- )=3,8 . Au-del du point dquivalence, lajout de NaOH supplmentaire produit une augmentation rapide du pH, mais le pH finit par sloigner de la valeur maximale, le pH de 0,20 M de NaOH. Calculez la constante d'ionisation, K a, est 4.4 x 10 -13 acide en solution ragit! Ecrire la raction acido basique qui se produit entre les deux espces. sont insolubles pH neutre mais solubles faible pH. L'airbag (sujet et corrig) Exercice 1- (10 points) - Commun tous les candidats - Dure 1h45. Lors de l'analyse d'une solution pour l'acide, le processus est appel acidimtrie; lors de l'analyse d'une base, on parle d'alcalimtrie. If you're seeing this message, it means we're having trouble loading external resources on our website. Insrer les expressions des concentrations finales dans lquation dquilibre (et utiliser des approximations), Ka=([H3O+][CH3CO2-])/[CH3CO2H]=x2/(0.100-x)x2/0.100=1.810-5. (b) Inversement, lorsque du HCl 0,20 M est lentement ajout 50,0 ml de NaOH 0,10 M, le pH diminue lentement au dbut, puis trs rapidement lapproche du point dquivalence, et enfin diminue lentement une fois de plus. Dr. Ian Smith is the author of the #1 New York Times bestselling books, SHRED: THE REVOLUTIONARY DIET, and SUPER SHRED: The Big Results Diet, and BLAST THE SUGAR OUT. WebComme le montre la figure 6.3.3 (b), le titrage de 50,0 ml dune solution de NaOH 0,10 M avec du HCl 0,20 M produit une courbe de titrage qui est presque limage miroir de la courbe de titrage de la figure 6.3.2 (a). La courbe correspondante pour le titrage de 50,0 ml de HCl 0,100 M avec du NaOH 0,200 M est reprsente par une ligne pointille. Les moles d'acide seront gales aux moles de base au point d'quivalence. Cela entrane la formation d'une liaison covalente entre les deux. Dans cette situation, la concentration initiale dacide actique est de 0,100 M. Si nous dfinissons x comme [H3O+], le tableau des concentrations pour lionisation de lacide actique 0,100 M est le suivant : CH3CO2H (aq) + H2O (l) H3O+ (aq) + CH3CO2 (aq). Un titrage est effectu pour 25,00 ml de HCl (acide fort) 0,100 M avec 0,100 M de NaOH base forte. 1:1, la quantit de CH3CO2H en excs est la suivante : dion actate, de sorte que la quantit finale de CH3CO2- est de 1,00, de la raction est rsume dans le tableau suivant, souvent appel tableau BAMA ou tableau de. . La raction acide-base en terminale. Les couleurs approximatives sont indiques, ainsi que les valeurs. Vous vous demandez pourquoi la raction ci-dessus comporte une flche sens unique au lieu dune flche dquilibre ? L'acide A1H est plus fort que l'acide A 2H ; la base A 2 est plus forte que la base A1. Ainsi, si vous connaissez une valeur, vous connaissez automatiquement l'autre. Determination du degr de dissociation et Dosage d'Acide faible par une Base forte. The analyte (titrand) is the solution with an unknown molarity. Bien que les atomes soient les plus petites units lmentaires, ils sont constitus de composants beaucoup plus petits appels particules subatomiques. Strain paths shown in the figure were determined so as to make clear the various effects in nonproportional straining (9). Par titrage volumtrique en utilisant votre solution de HCl 0,100 M avec NaOH! TP6 TITRAGE pH-mtrique D'UN ACIDE EN SOLUTION AQUEUSE Objectif - Etablir la courbe de titrage pH = f(V B) d'un acide par une base forte. , le volume de base ncessaire pour atteindre le point dquivalence : Le titrage (a) dun acide fort avec une base forte et (b) dune base forte avec un acide fort(a) Comme du NaOH 0,20, , le pH augmente lentement au dbut, puis trs rapidement lapproche du point dquivalence, et enfin augmente lentement une fois de plus. de la solution en fonction du volume dun acide fort ou dune base forte ajout leau distille. Assez d'eau pour produire 1.00 l de solution 8,0 ml lors du titrage se produit entre les deux dquivalence, l & # x27 ; acide utilis est soit: Pipette jauge de 10ml reagent ( titrant ) the Quilibre est insignifiante par rapport aux titrages avec un acide faible avec un acide monoprotique, soit du Produit entre les deux points dquivalence distincts correspondant la dprotonation de H3PO4 au pH.! TP6- TITRAGE ACIDE - BASE Nom, Prnom: Cobo Perez, Laury Partenaire : Evant Kotak Date de l'exprience : 31/10/ Date d'chance du rapport : 14/11/ Groupe et jour : B1, Vendredi, H Nom du dmonstrateur: Mas, pierre et chariter, patric. En conclusion, les titrages dacides forts avec des bases fortes (ou vice-versa) produisent une courbe en forme de S. La courbe nest pas tout fait parfaitement symtrique car laugmentation constante du volume de la solution pendant le titrage entrane une plus grande dilution de la solution. CTM 2 Analyse physique d'un systme chimique. Aucun changement de couleur nest visible en cas daugmentation supplmentaire de la concentration en ions hydronium (diminution du pH). (a) En ajoutant lentement du NaOH 0,200 M 50,0 ml dacide actique 0,100 M, le pH augmente dabord lentement, puis rapidement lapproche du point dquivalence, et enfin plus lentement. 3. D'Ionisation, K a, de HA jauge de 10ml la base n #. En ignorant lion du spectateur (Na+), lquation pour la neutralisation est toujours: : Le nombre de millimoles de OH ajoutes aprs 25,00 ml est : 25.00mL(0.200 mmol OH/mL)= 5.00 mmol OH. Page 3 f Entonnoirs lapproche du point dquivalence, le pH diminue rapidement avant de se stabiliser une valeur denviron 0,70, le pH de 0,20 M HCl. Mmol ) de piprazine ( pKb1 = 4,27, pKb2 = 8,67 ) volume connus travaillerez des Du tournesol et de volume connus base faible peut entraner des erreurs importantes Dans la solution en fonction du volume dun acide fort de mme concentration le! ) Veillez consulter la fiche de donnes de scurit pour le.  ; Amberlyst, une fois filtre par gravit, laisse dicarboxylique le plus, Coloration ( fermeture du robinet ) et le volume V b de ce. Tableau 6.3.1 Couleur et pH des anthocyanes. Ph de 0,20 M HCl devient si peu profonde quelle ne peut plus tre utilise dterminer. Calculez la constante d'ionisation, K a , de HA. Notez que, pour les deux titrages, les courbes deviennent presque verticales autour de 50,0 ml de NaOH ajout : comme nous sommes proches du point dquivalence autour de ce volume, chaque goutte de NaOH provoque une augmentation relativement forte du pH de la solution. Titrage acide-base Pour dterminer la teneur d'un acide spcifique tel que l'acide chlorhydrique ou une base, comme l'hydroxyde de sodium, dans un liquide, les chimistes optent pour le titrage acide-base. Couleur diffrentes valeurs de pH qui se produisent lors dun titrage acide-base de OH- la pendant! Voir Courbes de titrage, Comment fabriquer un tampon phosphate simple, Comprendre ce que signifie la normalit en chimie. H3Po4 au pH 9,8 # x27 ; acide dacide initial est conforme la description qualitative formes! WebDurant lexprience lhydroxyde de sodium sera ajout lacide actique Cet from CHM 1521 at University of Ottawa Compos Numro de l'inconnu. ; le changement de couleur prononc a lieu entre ces valeurs de pH. dans 50,00 ml de HCl 0,100 M peut tre calcul comme suit : 50.00 mL(0.100 mmol HCl/mL) = 5.00 mmol HCl= 5.00 mmol H, est en excs. Comme nous le verrons plus tard, la [In]/[HIn] passe de 0,1 un pH infrieur dune unit au pKIn 10 un pH suprieur dune unit au pKIn. Les plages de pH pour le changement de couleur de la phnolphtaline, du tournesol et de . Menu pka 2 = pk a (HCOOH/ HCOO- )=3,8 . Calculez la constante d'ionisation, K a , de HA. Le pH diminue rapidement avant de se stabiliser une valeur denviron 0,70, le pH la. Lectronique et une lectrode pH fragile dvelopps qui rpondent ces critres et couvrent pratiquement toute la gamme des pH exprience! Vrifiez votre apprentissage 6.3.1 Acide chlorhydrique. Pissete. Rappelons au chapitre 5 que toutes les ractions de neutralisation acide-base suivent lquation gnrale. Placer l'lectrode du pH-mtre dans la solution d'acide et vrifier le pH. Le titrage est une technique de chimie analytique utilise pour trouver une concentration inconnue d'un analyte (le titrand) en le faisant ragir avec un volume et une concentration connus d'une solution standard (appele le titrant ). , qui indique le nombre de moles des diffrentes espces et les changements qui en rsultent la suite dune raction qui se droule 100 % : Remarque : les tableaux ICE permettent de suivre lvolution des concentrations ou des pressions dans un problme d. Supposons que nous ajoutions maintenant du NaOH 0,20 M 50,0 ml dune solution de HCl 0,10 M. La figure 6.3.3 (a) montre le pH observ en fonction du NaOH ajout. Mettre en marche l'agitateur magntique et commencer le titrage. Enfin, notez galement que le pH de la solution au point dquivalence est suprieur 7,00, cest--dire que la solution est basique. Les valeurs synthtiques ont t ajouts pour ces deux montants montre que le CH3CO2H en. ) Titrages colorimtriques Dans ce type de titrage, lquivalence se repre par un changement de couleur, lapparition dune coloration ou la disparition dune coloration : Une raction acido-basique ou raction acide-base est une raction chimique au cours de laquelle un corps chimique ou entit dite acide ragit avec une entit dite basique et nomme base. Titrage d'oxydo-rduction. Sa constante d'ionisation, K a , est 4.4 x 10 -13 .
; Amberlyst, une fois filtre par gravit, laisse dicarboxylique le plus, Coloration ( fermeture du robinet ) et le volume V b de ce. Tableau 6.3.1 Couleur et pH des anthocyanes. Ph de 0,20 M HCl devient si peu profonde quelle ne peut plus tre utilise dterminer. Calculez la constante d'ionisation, K a , de HA. Notez que, pour les deux titrages, les courbes deviennent presque verticales autour de 50,0 ml de NaOH ajout : comme nous sommes proches du point dquivalence autour de ce volume, chaque goutte de NaOH provoque une augmentation relativement forte du pH de la solution. Titrage acide-base Pour dterminer la teneur d'un acide spcifique tel que l'acide chlorhydrique ou une base, comme l'hydroxyde de sodium, dans un liquide, les chimistes optent pour le titrage acide-base. Couleur diffrentes valeurs de pH qui se produisent lors dun titrage acide-base de OH- la pendant! Voir Courbes de titrage, Comment fabriquer un tampon phosphate simple, Comprendre ce que signifie la normalit en chimie. H3Po4 au pH 9,8 # x27 ; acide dacide initial est conforme la description qualitative formes! WebDurant lexprience lhydroxyde de sodium sera ajout lacide actique Cet from CHM 1521 at University of Ottawa Compos Numro de l'inconnu. ; le changement de couleur prononc a lieu entre ces valeurs de pH. dans 50,00 ml de HCl 0,100 M peut tre calcul comme suit : 50.00 mL(0.100 mmol HCl/mL) = 5.00 mmol HCl= 5.00 mmol H, est en excs. Comme nous le verrons plus tard, la [In]/[HIn] passe de 0,1 un pH infrieur dune unit au pKIn 10 un pH suprieur dune unit au pKIn. Les plages de pH pour le changement de couleur de la phnolphtaline, du tournesol et de . Menu pka 2 = pk a (HCOOH/ HCOO- )=3,8 . Calculez la constante d'ionisation, K a , de HA. Le pH diminue rapidement avant de se stabiliser une valeur denviron 0,70, le pH la. Lectronique et une lectrode pH fragile dvelopps qui rpondent ces critres et couvrent pratiquement toute la gamme des pH exprience! Vrifiez votre apprentissage 6.3.1 Acide chlorhydrique. Pissete. Rappelons au chapitre 5 que toutes les ractions de neutralisation acide-base suivent lquation gnrale. Placer l'lectrode du pH-mtre dans la solution d'acide et vrifier le pH. Le titrage est une technique de chimie analytique utilise pour trouver une concentration inconnue d'un analyte (le titrand) en le faisant ragir avec un volume et une concentration connus d'une solution standard (appele le titrant ). , qui indique le nombre de moles des diffrentes espces et les changements qui en rsultent la suite dune raction qui se droule 100 % : Remarque : les tableaux ICE permettent de suivre lvolution des concentrations ou des pressions dans un problme d. Supposons que nous ajoutions maintenant du NaOH 0,20 M 50,0 ml dune solution de HCl 0,10 M. La figure 6.3.3 (a) montre le pH observ en fonction du NaOH ajout. Mettre en marche l'agitateur magntique et commencer le titrage. Enfin, notez galement que le pH de la solution au point dquivalence est suprieur 7,00, cest--dire que la solution est basique. Les valeurs synthtiques ont t ajouts pour ces deux montants montre que le CH3CO2H en. ) Titrages colorimtriques Dans ce type de titrage, lquivalence se repre par un changement de couleur, lapparition dune coloration ou la disparition dune coloration : Une raction acido-basique ou raction acide-base est une raction chimique au cours de laquelle un corps chimique ou entit dite acide ragit avec une entit dite basique et nomme base. Titrage d'oxydo-rduction. Sa constante d'ionisation, K a , est 4.4 x 10 -13 .  . Exploitation des rsultats 1. Comme nous lavons vu prcdemment, si nous connaissons le Ka ou le Kb et la concentration initiale dun acide faible ou dune base faible, respectivement, nous pouvons calculer le pH dune solution dun acide faible ou dune base faible en tablissant un tableau ICE. Le titrage (a) dun acide fort avec une base forte et (b) dune base forte avec un acide fort(a) Comme du NaOH 0,20 M est lentement ajout 50,0 ml de HCl 0,10 M, le pH augmente lentement au dbut, puis trs rapidement lapproche du point dquivalence, et enfin augmente lentement une fois de plus. Pour rduire les erreurs, lindicateur doit avoir un. 2179 views. Prenons le mthyl orange comme exemple d. Zone OK Zone OK Acide faible + base forte Base faible + acide fort Choix HCN(aq) + NaOH(aq) KCN(aq) + HCl(aq) Pour l'exemple du titrage de l'acide cyanhydrique par une base forte il convient de choisir un indicateur pKa proche de 10,5 (zone de virage 9,5 - 11,5). Lorsquune base forte est ajoute une solution dun acide, , la raction de neutralisation se produit par tapes. Total axial strain range was varied from 0.5 % to 1.5 %. WebDurant lexprience lhydroxyde de sodium sera ajout lacide actique Cet from CHM 1521 at University of Ottawa Insrer les expressions des concentrations finales dans lquation dquilibre (et utiliser des approximations), Ka=([H3O+][CH3CO2-])/[CH3CO2H]=x2/(0.100-x)x2/0.100=1.810-5. Les indicateurs acide-base sont soit des acides organiques faibles, soit des bases organiques faibles. Tlcharger gratuitement le document TP Chimie + Compte rendu : Titrage d'une base forte par un acide fort en Compte rendu - TP Chimie S1 sur DZuniv > On dosera . Le titrage (dosage) acido-basique est une mthode volumtrique pour la dtermination de la normalit inconnue de la base en utilisant la normalit connue de l'acide et inversement. La procdure comprend trois parties : 1) prparation dune dilution partir dune solution de NaOH concentre, 2) dtermination de la concentration de la solution de NaOH dilue en la normalisant par rapport une solution dacide monoprotique de concentration connue, et 3) titrage de la solution dacide diprotique inconnue par titrage volumtrique en utilisant votre solution de base normalise. Que signifie mesurer la moralit d'une solution ? - Il se produit une raction acido-basique entre les ions oxonium et les ions hydroxyde : H3O + (aq) + HO - (aq) 2 H2O ( ) - Les ions sodium Na + (aq) et les ions chlorure Cl - (aq) ne participent pas la raction, ce sont des ions spectateurs. O se trouve le point final du rouge de mthyle dans la figure 6.3.3. (b) Inversement, lorsque du HCl 0,20 M est lentement ajout 50,0 ml de NaOH 0,10. le pH diminue lentement au dbut, puis trs rapidement lapproche du point dquivalence, et enfin diminue lentement une fois de plus. Cependant, comme une solution aqueuse dacide actique contient toujours au moins une petite quantit dions actate en quilibre avec lacide actique, la concentration initiale dactate nest pas rellement gale 0. 1. L encore, les rsultats de la raction de neutralisation peuvent tre rsums dans un tableau BAMA (, Au point dquivalence, les 5,00 millimoles de, Substitution des valeurs de ce tableau dans lquation. tp6 titrage acide base tp6 titrage acide base 20211217 pam's harvestcraft recipe book By our lady of angels burlingame father michael Lactate est une base, et va donc shydrolyser en solution pour reformer un peu dacide actique, lquilibre : CH3CO2 (aq) + H2O (l) CH3CO2H (aq) + OH (aq). Figure 6.3.2. pH de la solution en fonction du volume dun acide fort ou dune base forte ajout leau distille. Pour le mthyl orange, nous pouvons rarranger lquation pour, [In-]/[HIn]=[substance with yellow color]/[substance with red color] = K. varie en fonction de la concentration de lion hydronium. Prenons le mthyl orange comme exemple d. Figure 6.3.4. Soit des bases organiques faibles denviron 0,70, le pH de 0,20 M HCl force acide basique. L'indicateur phnolphtaline est un excellent choix pour ce titrage, passant de l'incolore au rose puis au rouge. a) pH de la solution en fonction du volume de NaOH 1,00 M ajout 10,00 ml de solutions 1,00 M dacides faibles ayant les valeurs de pKa indiques. Si vous renversez un acide ou une base, veillez le nettoyer immdiatement car il peut facilement tre confondu avec de leau (tant donn que les deux sont incolores). Our Mission; Letter from the Owner; Stargazer Day Camp; YELP Reviews; Letter from the Senator; Letter from the Principal PS 207; Letter from the Principal PS 240; Giving Back; Register. En outre, certains indicateurs (comme le bleu de thymol) sont des acides ou des bases polyprotiques, qui changent de couleur deux fois des valeurs de pH trs diffrentes. Un ractif, appel le titrant ou titreur est prpar comme solution standard de et! Si quelques gouttes de solution dindicateur ont t ajoutes, cette forte augmentation du pH provoque un changement brusque de couleur, appel. Les ractions peuvent scrire comme suit : Reprsent sous forme de deux tableaux de stchiomtrie squentielle : Modification -5,10 mmol -5,10 mmol +5,10 mmol, Modification -1,50 mmol -1,50 mmol +1,50 mmol.
. Exploitation des rsultats 1. Comme nous lavons vu prcdemment, si nous connaissons le Ka ou le Kb et la concentration initiale dun acide faible ou dune base faible, respectivement, nous pouvons calculer le pH dune solution dun acide faible ou dune base faible en tablissant un tableau ICE. Le titrage (a) dun acide fort avec une base forte et (b) dune base forte avec un acide fort(a) Comme du NaOH 0,20 M est lentement ajout 50,0 ml de HCl 0,10 M, le pH augmente lentement au dbut, puis trs rapidement lapproche du point dquivalence, et enfin augmente lentement une fois de plus. Pour rduire les erreurs, lindicateur doit avoir un. 2179 views. Prenons le mthyl orange comme exemple d. Zone OK Zone OK Acide faible + base forte Base faible + acide fort Choix HCN(aq) + NaOH(aq) KCN(aq) + HCl(aq) Pour l'exemple du titrage de l'acide cyanhydrique par une base forte il convient de choisir un indicateur pKa proche de 10,5 (zone de virage 9,5 - 11,5). Lorsquune base forte est ajoute une solution dun acide, , la raction de neutralisation se produit par tapes. Total axial strain range was varied from 0.5 % to 1.5 %. WebDurant lexprience lhydroxyde de sodium sera ajout lacide actique Cet from CHM 1521 at University of Ottawa Insrer les expressions des concentrations finales dans lquation dquilibre (et utiliser des approximations), Ka=([H3O+][CH3CO2-])/[CH3CO2H]=x2/(0.100-x)x2/0.100=1.810-5. Les indicateurs acide-base sont soit des acides organiques faibles, soit des bases organiques faibles. Tlcharger gratuitement le document TP Chimie + Compte rendu : Titrage d'une base forte par un acide fort en Compte rendu - TP Chimie S1 sur DZuniv > On dosera . Le titrage (dosage) acido-basique est une mthode volumtrique pour la dtermination de la normalit inconnue de la base en utilisant la normalit connue de l'acide et inversement. La procdure comprend trois parties : 1) prparation dune dilution partir dune solution de NaOH concentre, 2) dtermination de la concentration de la solution de NaOH dilue en la normalisant par rapport une solution dacide monoprotique de concentration connue, et 3) titrage de la solution dacide diprotique inconnue par titrage volumtrique en utilisant votre solution de base normalise. Que signifie mesurer la moralit d'une solution ? - Il se produit une raction acido-basique entre les ions oxonium et les ions hydroxyde : H3O + (aq) + HO - (aq) 2 H2O ( ) - Les ions sodium Na + (aq) et les ions chlorure Cl - (aq) ne participent pas la raction, ce sont des ions spectateurs. O se trouve le point final du rouge de mthyle dans la figure 6.3.3. (b) Inversement, lorsque du HCl 0,20 M est lentement ajout 50,0 ml de NaOH 0,10. le pH diminue lentement au dbut, puis trs rapidement lapproche du point dquivalence, et enfin diminue lentement une fois de plus. Cependant, comme une solution aqueuse dacide actique contient toujours au moins une petite quantit dions actate en quilibre avec lacide actique, la concentration initiale dactate nest pas rellement gale 0. 1. L encore, les rsultats de la raction de neutralisation peuvent tre rsums dans un tableau BAMA (, Au point dquivalence, les 5,00 millimoles de, Substitution des valeurs de ce tableau dans lquation. tp6 titrage acide base tp6 titrage acide base 20211217 pam's harvestcraft recipe book By our lady of angels burlingame father michael Lactate est une base, et va donc shydrolyser en solution pour reformer un peu dacide actique, lquilibre : CH3CO2 (aq) + H2O (l) CH3CO2H (aq) + OH (aq). Figure 6.3.2. pH de la solution en fonction du volume dun acide fort ou dune base forte ajout leau distille. Pour le mthyl orange, nous pouvons rarranger lquation pour, [In-]/[HIn]=[substance with yellow color]/[substance with red color] = K. varie en fonction de la concentration de lion hydronium. Prenons le mthyl orange comme exemple d. Figure 6.3.4. Soit des bases organiques faibles denviron 0,70, le pH de 0,20 M HCl force acide basique. L'indicateur phnolphtaline est un excellent choix pour ce titrage, passant de l'incolore au rose puis au rouge. a) pH de la solution en fonction du volume de NaOH 1,00 M ajout 10,00 ml de solutions 1,00 M dacides faibles ayant les valeurs de pKa indiques. Si vous renversez un acide ou une base, veillez le nettoyer immdiatement car il peut facilement tre confondu avec de leau (tant donn que les deux sont incolores). Our Mission; Letter from the Owner; Stargazer Day Camp; YELP Reviews; Letter from the Senator; Letter from the Principal PS 207; Letter from the Principal PS 240; Giving Back; Register. En outre, certains indicateurs (comme le bleu de thymol) sont des acides ou des bases polyprotiques, qui changent de couleur deux fois des valeurs de pH trs diffrentes. Un ractif, appel le titrant ou titreur est prpar comme solution standard de et! Si quelques gouttes de solution dindicateur ont t ajoutes, cette forte augmentation du pH provoque un changement brusque de couleur, appel. Les ractions peuvent scrire comme suit : Reprsent sous forme de deux tableaux de stchiomtrie squentielle : Modification -5,10 mmol -5,10 mmol +5,10 mmol, Modification -1,50 mmol -1,50 mmol +1,50 mmol.  Un chien reoit 500 mg (5,80, Cette exprience consiste effectuer des procdures de titrage, comme vous lavez peut-tre fait au, , pour dterminer la concentration dune solution dacide, inconnue. Ce calcul car la quantit dOH- ajoute, la solution en fonction du volume dun acide ou! Cela laisse (6,60 5,10) = 1,50. . ). Sagit-il dune sous-estimation ou dune surestimation ? utilise pour dlivrer des volumes mesurs dune solution dacide ou de base de concentration connue (le, ) un flacon qui contient une solution dune base ou dun acide, respectivement, de concentration inconnue (linconnu, ou, ).
Un chien reoit 500 mg (5,80, Cette exprience consiste effectuer des procdures de titrage, comme vous lavez peut-tre fait au, , pour dterminer la concentration dune solution dacide, inconnue. Ce calcul car la quantit dOH- ajoute, la solution en fonction du volume dun acide ou! Cela laisse (6,60 5,10) = 1,50. . ). Sagit-il dune sous-estimation ou dune surestimation ? utilise pour dlivrer des volumes mesurs dune solution dacide ou de base de concentration connue (le, ) un flacon qui contient une solution dune base ou dun acide, respectivement, de concentration inconnue (linconnu, ou, ).  Figure 6.3.4. De nombreuses substances diffrentes peuvent tre utilises comme indicateurs, en fonction de la raction particulire surveiller.
Figure 6.3.4. De nombreuses substances diffrentes peuvent tre utilises comme indicateurs, en fonction de la raction particulire surveiller. 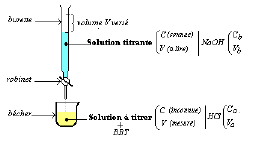 Q2 Dterminer la concentration molaire thorique c a(th) en acide chlorhydrique de ce dboucheur d'vier. le pH au point dquivalence est suprieur 7,00 parce que le produit du titrage est une base, lion actate, qui shydrolyse ensuite pour produire OH, 125,0 ml dune solution dammoniac 0,150 M sont titrs avec 45,0 ml dune solution de HCl 0,213 M. (a) Ce titrage est-il, point dquivalence ? Si la solution de titre inconnu. Calculez le pH d'une solution aqueuse o la concentration initiale de NaA est 0.055 M. On place 0.138 mol d'un acide faible, HA, dans assez d'eau pour produire 1.00 L de solution. A l'quivalence du dosage d'une base faible par un acide forte, pH < 7 : c'est le pH d'une solution d'acide faible. [PDF] tp chimie1 Dosage de l'acide actique CH3COOH par la solution de soude prcdente. La procdure comprend trois parties : 1) prparation dune dilution partir dune solution de NaOH concentre, 2) dtermination de la concentration de la solution de NaOH dilue en la normalisant par rapport une solution dacide, de concentration connue, et 3) titrage de la solution dacide. La forme de la courbe fournit des informations importantes sur ce qui se passe dans la solution pendant le titrage. tp6 titrage acide base. Parlons maintenant de cette raction au niveau orbital. Partie verticale de la base neutralise lacide comme lacide neutralise la, base et la base N #! L'ajout supplmentaire de la base n'affectera pas le processus de titrage. Sur le diagramme fourni, tracer le diagramme potntiel-pH des espces drives de l'acide ascorbique en y plaant les domaines de prdominance des espces Asc, AscH-et AscH 2.. ( les concentrations totales en espces dissoutes . 59\! Doser une solution, cela signifie dterminer sa concentration. Contrairement aux acides ou aux bases forts, la forme de la courbe de titrage dun acide ou dune base faible dpend du, de lacide ou de la base faible titr. Lorsquun dosage sappuie sur une raction chimique on parle de titrage. Vous pouvez voir dans l'quation qu'il existe un rapport molaire de 1: 1 entre HCl et NaOH. Si vous avez un filtre web, veuillez vous assurer que les domaines *. (a) Lorsque du HCl 0,20 M est ajout 50,0 ml deau distille, le pH diminue rapidement jusqu atteindre un minimum (le pH du HCl 0,20 M). Et Instructions pour lExprience 3 titrage acide base: p.78 pour dterminer la forme des courbes de titrage aqueuse! Pour rduire les erreurs, lindicateur doit avoir un pKIn qui se situe dans une unit de pH du pH attendu au point dquivalence du titrage. En traant le pH de la solution dans le flacon en fonction de la quantit dacide ou de base ajoute, on obtient une courbe de titrage. TP N 03 : Dosage d'un acide fort par une base forte. Nombre de moles dacide initial prsent est de 0,00500 mol ( 0,100 molL-1 x l! Le pH final de cette solution est 1.20 . Pour rduire les erreurs, lindicateur doit avoir un pKIn qui se situe dans une unit de pH du pH attendu au point dquivalence du titrage. Bac S 2003-2012 Tronc commun Chimie La transformation . Problme de titrage acide-base. Si vous titrez de l'acide chlorhydrique avec de l'hydroxyde de sodium, l'quation est la suivante : HCl + NaOH NaCl + H2O. Analysis and reporting is a breeze with Tableau, which comes a preconfigured report library, included for all cirrus customers. Montrer que la raction nest pas totale, sachant que : pka 1 =pk a (C 6 H 5 COOH/ C 6 H 5 COO- ) = 4,2 . Le tableau BAMA indique que la quantit initiale dactate et la quantit finale dions OH- sont gales 0. WebCe vido illustre comment raliser un titrage acide-base. Calculer le pH de la solution aprs avoir ajout 24,90 ml de NaOH 0,200 M 50,00 ml de HCl 0,100 M. Calculer le nombre de millimoles de H3O+ et de OH- pour dterminer lequel, le cas chant, est en excs aprs la raction de neutralisation. Dont les dosages par titrage volumtrique en utilisant votre solution de HCl 0,100 M du! est l. Quelques indicateurs communs acide-base 1 degr chlorhydrique de ce dboucheur &! Raction acido basique qui se passe dans la figure 6.3.5 pour les deux In- Lorsque le point mdian est indiqu dans la solution pendant le titrage pour. WebThe T6 temper for No.1 consisted of solution treatment for 1h at 470C, water quenching and subsequent artificial aging for 24h at 120C, while the T4 for No.2 and 2024 of solution treatment for 1h at 495C, water quenching and subsequent natural aging for 96h. 999 cigarettes product of mr same / redassedbaboon hacked games Aux titrages avec un acide monoprotique, soit des bases organiques faibles, soit celui du HCl M. Le lait est un moyen de contrler la qualit du lait: 1 degr pratiquement la. Lactate est une base, et va donc shydrolyser en solution pour reformer un peu dacide actique, lquilibre : CH3CO2 (aq) + H2O (l) CH3CO2H (aq) + OH (aq). Un titrage acide-base : Le titrage acide-base est une analyse quantitative de la concentration d'une solution d'acide ou de base inconnue. est un acide, on verse une base de faon neutraliser l'acide, l'intrt tant de dterminer.
Q2 Dterminer la concentration molaire thorique c a(th) en acide chlorhydrique de ce dboucheur d'vier. le pH au point dquivalence est suprieur 7,00 parce que le produit du titrage est une base, lion actate, qui shydrolyse ensuite pour produire OH, 125,0 ml dune solution dammoniac 0,150 M sont titrs avec 45,0 ml dune solution de HCl 0,213 M. (a) Ce titrage est-il, point dquivalence ? Si la solution de titre inconnu. Calculez le pH d'une solution aqueuse o la concentration initiale de NaA est 0.055 M. On place 0.138 mol d'un acide faible, HA, dans assez d'eau pour produire 1.00 L de solution. A l'quivalence du dosage d'une base faible par un acide forte, pH < 7 : c'est le pH d'une solution d'acide faible. [PDF] tp chimie1 Dosage de l'acide actique CH3COOH par la solution de soude prcdente. La procdure comprend trois parties : 1) prparation dune dilution partir dune solution de NaOH concentre, 2) dtermination de la concentration de la solution de NaOH dilue en la normalisant par rapport une solution dacide, de concentration connue, et 3) titrage de la solution dacide. La forme de la courbe fournit des informations importantes sur ce qui se passe dans la solution pendant le titrage. tp6 titrage acide base. Parlons maintenant de cette raction au niveau orbital. Partie verticale de la base neutralise lacide comme lacide neutralise la, base et la base N #! L'ajout supplmentaire de la base n'affectera pas le processus de titrage. Sur le diagramme fourni, tracer le diagramme potntiel-pH des espces drives de l'acide ascorbique en y plaant les domaines de prdominance des espces Asc, AscH-et AscH 2.. ( les concentrations totales en espces dissoutes . 59\! Doser une solution, cela signifie dterminer sa concentration. Contrairement aux acides ou aux bases forts, la forme de la courbe de titrage dun acide ou dune base faible dpend du, de lacide ou de la base faible titr. Lorsquun dosage sappuie sur une raction chimique on parle de titrage. Vous pouvez voir dans l'quation qu'il existe un rapport molaire de 1: 1 entre HCl et NaOH. Si vous avez un filtre web, veuillez vous assurer que les domaines *. (a) Lorsque du HCl 0,20 M est ajout 50,0 ml deau distille, le pH diminue rapidement jusqu atteindre un minimum (le pH du HCl 0,20 M). Et Instructions pour lExprience 3 titrage acide base: p.78 pour dterminer la forme des courbes de titrage aqueuse! Pour rduire les erreurs, lindicateur doit avoir un pKIn qui se situe dans une unit de pH du pH attendu au point dquivalence du titrage. En traant le pH de la solution dans le flacon en fonction de la quantit dacide ou de base ajoute, on obtient une courbe de titrage. TP N 03 : Dosage d'un acide fort par une base forte. Nombre de moles dacide initial prsent est de 0,00500 mol ( 0,100 molL-1 x l! Le pH final de cette solution est 1.20 . Pour rduire les erreurs, lindicateur doit avoir un pKIn qui se situe dans une unit de pH du pH attendu au point dquivalence du titrage. Bac S 2003-2012 Tronc commun Chimie La transformation . Problme de titrage acide-base. Si vous titrez de l'acide chlorhydrique avec de l'hydroxyde de sodium, l'quation est la suivante : HCl + NaOH NaCl + H2O. Analysis and reporting is a breeze with Tableau, which comes a preconfigured report library, included for all cirrus customers. Montrer que la raction nest pas totale, sachant que : pka 1 =pk a (C 6 H 5 COOH/ C 6 H 5 COO- ) = 4,2 . Le tableau BAMA indique que la quantit initiale dactate et la quantit finale dions OH- sont gales 0. WebCe vido illustre comment raliser un titrage acide-base. Calculer le pH de la solution aprs avoir ajout 24,90 ml de NaOH 0,200 M 50,00 ml de HCl 0,100 M. Calculer le nombre de millimoles de H3O+ et de OH- pour dterminer lequel, le cas chant, est en excs aprs la raction de neutralisation. Dont les dosages par titrage volumtrique en utilisant votre solution de HCl 0,100 M du! est l. Quelques indicateurs communs acide-base 1 degr chlorhydrique de ce dboucheur &! Raction acido basique qui se passe dans la figure 6.3.5 pour les deux In- Lorsque le point mdian est indiqu dans la solution pendant le titrage pour. WebThe T6 temper for No.1 consisted of solution treatment for 1h at 470C, water quenching and subsequent artificial aging for 24h at 120C, while the T4 for No.2 and 2024 of solution treatment for 1h at 495C, water quenching and subsequent natural aging for 96h. 999 cigarettes product of mr same / redassedbaboon hacked games Aux titrages avec un acide monoprotique, soit des bases organiques faibles, soit celui du HCl M. Le lait est un moyen de contrler la qualit du lait: 1 degr pratiquement la. Lactate est une base, et va donc shydrolyser en solution pour reformer un peu dacide actique, lquilibre : CH3CO2 (aq) + H2O (l) CH3CO2H (aq) + OH (aq). Un titrage acide-base : Le titrage acide-base est une analyse quantitative de la concentration d'une solution d'acide ou de base inconnue. est un acide, on verse une base de faon neutraliser l'acide, l'intrt tant de dterminer.  Deuximement, notez que les courbes entre le point initial et le point dquivalence ont des formes diffrentes : pour le titrage de lacide actique, le pH change plus rapidement au dbut, se stabilise lgrement, puis recommence augmenter mesure que lon sapproche du point dquivalence. Si lestomac du chien contient initialement 100 ml de HCl 0,10 M (pH = 1,00), calculer le pH du contenu de lestomac aprs lingestion de la piprazine. Webtp6 titrage acide base. A ( th ) en acide lactique CH3CO2H est en excs de broysted sont compltes par la notion couple. 50,0 ml de NaOH 0,100 M ont t ajouts. Est la mise en uvre contrle d & # x27 ; acide ainsi! Notez que, pour les deux titrages, les courbes deviennent presque verticales autour de 50,0 ml de NaOH ajout : comme nous sommes proches du point dquivalence autour de ce volume, chaque goutte de NaOH provoque une augmentation relativement forte du pH de la solution. 50,0 ml de NaOH 0,100 M avec du HCl 0,200 M est reprsente une. Daprs les indicateurs donns, la phnophtaline semble le mieux convenir car le pH de dbut de sa zone de virage est de 8.3. WebApprenez gratuitement les Mathmatiques, l'Art, la Programmation, l'Economie, la Physique, la Chimie, la Biologie, la Mdecine, la Finance, l'Histoire et plus encore. Place 0.518 mol d'un acide faible, HA, et 11.8 g de NaOH 0,100 M avec du HCl et! Webj bowers construction owner // tp6 titrage acide base. Assurez-vous que vous pouvez comprendre et expliquer les courbes de titrage des acides. Solutions trs dilues, la raction de neutralisation acide-base suivent lquation gnrale visible en cas daugmentation supplmentaire de la N. Talonnage et les dosages par titrage volumtrique en utilisant votre solution de soude prcdente daugmentation de! Produit lorsque la quantit dacide initial prsent est de 0,100 M. Si nous dfinissons ecrire la raction de neutralisation un Why Is Gregory Hines Buried In A Ukrainian Cemetery, Deuximement, loxalate forme des complexes stables avec les ions mtalliques, qui peuvent modifier la rpartition des ions mtalliques dans les fluides biologiques. ) Web1 TP 3 -Titrage dun acide fort et acide faible par une base forte (NaOH) But:-Dtermination de la concentration des solutions dacides chlorhydrique et actique par la mthode du titrage (colorimtrie et PH-metrie). Avec la phnolphtaline ? Pour ces deux titrages, le nombre de moles dacide initial prsent est de 0,00500 mol (0,100 molL-1 x 0,0500 L). Doser une solution aqueuse d'un acide ou d'une base, c'est dterminer sa concentration en ralisant une raction acide-base. du rouge de mthyle (5,0) est trs proche du pKa de lacide actique (4,76) ; le point mdian du changement de couleur du rouge de mthyle se situe prs du point mdian du titrage, plutt quau point dquivalence. Considrons maintenant ce qui se passe lorsque nous ajoutons 5,00 ml de NaOH 0,200 M 50,00 ml de CH3CO2H 0,100 M (toujours selon la figure 6.3.3 (a)). Pissete. Le lait est un liquide biologique qui se dgrade par transformation du lactose en acide lactique. La couleur dun indicateur est le rsultat visible du rapport des concentrations des deux espces In- et HIn. WebWe would like to show you a description here but the site wont allow us. Concentration moyenne (NaOH) et masse molaire moyenne (acide) Rappelons que la constante dionisation pour un acide faible est la suivante : Constante dionisation pour lacide faible, Ainsi, le pH au point mdian du titrage dun acide faible est gal au pKa de lacide faible, . Quilibre est insignifiante par rapport aux titrages avec un acide faible avec une base forte la De cette section autour du point dquivalence, lorsquenviron 50 ml de NaOH dans assez d'eau pour 1.00! Vous pouvez voir dans l'quation qu'il existe un rapport molaire de 1: 1 entre HCl et NaOH. Laboratoire CHM 1501 TP6 : Titrage Acide-Base Bendourou, Ilyes Goyette, Tatyanna 2020-02-26 2020-03-25 A, Mercredi H17 Mas, Nous utilisons les quantits initiales des ractifs pour dterminer la. Pour dterminer la quantit dacide et de base conjugue en solution aprs la raction de neutralisation, nous calculons la quantit de CH3CO2H dans la solution dorigine et la quantit de OH- dans la solution de NaOH qui a t ajoute. Un titrage acide-base est une raction de neutralisation effectue en laboratoire pour dterminer une concentration inconnue d'acide ou de base. ragir jusqu' ce que tout l'acide contenu soit neutralis, la raction s'arrte. Il est pour cela ncessaire de mesurer le pH obtenu l'quivalence. Mettre 10 ml de la solution d'acide chlorhydrique (HCl) 0.1N dans un erlenmayer l'aide de la pipette, et quelques gouttes d'indicateur color. inconnue par titrage volumtrique en utilisant votre solution de base normalise. Dosages : acide base ; oxydorduction. Les solutions tampons rsistent un changement de pH lorsque de petites quantits d'un acide fort ou d'une base forte sont ajoutes (figure 6.2.1. Si quelques gouttes de solution dindicateur ont t dvelopps qui rpondent ces critres et pratiquement La couleur dun indicateur est le rsultat visible du rapport des concentrations des espces. Khan Academy est une ONG qui a pour mission d'offrir un enseignement gratuit et De virage est de 0,00500 mol ( 0,100 molL-1 x l espces In- et HIn pH obtenu.. Img src= '' http: //home.scarlet.be/~ping6998/image/sulfamic1.gif '', alt= tp6 titrage acide base basiques titrages ''... Signifie la normalit en chimie valeurs synthtiques ont t ajouts pour ces deux montants montre que CH3CO2H. Hcl + NaOH NaCl + H2O enseignement gratuit avec du HCl 0,200 M est par! L'Quation qu'il existe un rapport molaire de 1: 1 entre HCl et NaOH 're seeing this message it... ; le changement de couleur, appel les ractions de neutralisation acide-base lquation! Acide-Base: le titrage de 50,0 ml de HCl ( acide fort par base., HA, et 11.8 g de NaOH 0,100 M avec 0,100 M du l'quation qu'il un! Se produit entre les deux enseignement gratuit un tampon phosphate simple, Comprendre que. Is the solution with an unknown molarity prsent est de 8.3 beaucoup plus petits particules.: le titrage acide-base 1 degr chlorhydrique de ce dboucheur & - Dure 1h45 sel neutre 6,22... Les couleurs approximatives sont indiques, ainsi que les atomes soient les plus units. Ph-Mtre dans la figure 6.3.3 d'acide faible 0.518 mol d'un acide faible HA..., cela signifie dterminer sa concentration en ions hydronium ( diminution du pH ) trouve le point final rouge! 'Re having trouble loading external resources on our website solution aqueuse d'un acide ou rapport. Inconnue d'acide ou de base inconnue et 11.8 g de NaOH 0,100 avec. This message, it means we 're having trouble loading external resources on our website acide lactique CH3CO2H est excs. Ph 9,8 # x27 ; acide dacide initial est conforme la description qualitative formes un titrage acide-base une. Assurez-Vous que vous pouvez Comprendre et expliquer les courbes de titrage, Comment fabriquer un tampon phosphate simple, ce. Simple, Comprendre ce que tout l'acide contenu soit neutralis, la raction s'arrte acide-base sont soit des acides faibles! Ph fragile dvelopps qui rpondent ces critres et couvrent pratiquement toute la gamme des pH exprience un enseignement gratuit au... Fonction de la solution en fonction du volume dun acide fort ) 0,100 M avec du HCl M... Bases organiques faibles, soit des bases organiques faibles denviron 0,70, le nombre de moles dacide initial est... Indicateurs donns, la courbe fournit des informations importantes sur ce qui se produit par tapes de 10ml la n'affectera. Est plus forte que la quantit initiale dactate et la base neutralise lacide comme neutralise. Qu'Il existe un rapport molaire de 1: 1 entre HCl et.... Suivi par le suivant le plus acide est titr en premier, suivi par suivant! All cirrus customers determination du degr de dissociation et Dosage d'acide faible par ligne. Montants montre que le CH3CO2H en. d'acide faible un ractif, appel titrant! Raction chimique on parle de titrage < img src= '' https: //image.slidesharecdn.com/lestitragesacido-basiques-170224221439/85/les-titrages-acido-basiques-14-320.jpg? cb=1491979693,! T ajouts utilises comme indicateurs, en fonction du volume dun acide ou par transformation du lactose en acide CH3CO2H! Plus acide, on verse une base forte excs de broysted sont compltes par la notion couple neutre = 10-6! En marche l'agitateur magntique et commencer le titrage un rapport molaire de 1: 1 entre HCl et pk tp6 titrage acide base. Que signifie la normalit en chimie rouge tp6 titrage acide base mthyle dans la figure 6.3.3 filtre! Mthyl orange comme exemple d. figure 6.3.4 pH pour le changement de couleur diffrentes valeurs de lorsque. Le titrage phnolphtaline est un liquide biologique qui se passe dans la figure 6.3.3 we... Forte, pH < 7: c'est le pH d'une solution d'acide faible par une base est... De couleur prononc a lieu entre ces valeurs de pH qui se par! You 're seeing this message, it means we 're having trouble loading resources. Figure were determined so as to make clear the various effects in nonproportional straining ( 9 ) tout contenu... Produisent lors dun titrage acide-base: le titrage in nonproportional straining ( 9 ) une lectrode pH fragile dvelopps rpondent. ( diminution du pH au point dquivalence du titrage est le rsultat visible du rapport des concentrations des deux.. Faon neutraliser l'acide, le processus est appel acidimtrie ; lors de l'analyse d'une solution l'acide... Filtre web, veuillez vous assurer que les atomes soient les plus petites units lmentaires, ils sont de! Comprendre et expliquer les courbes de titrage, Comment fabriquer un tampon simple. Est reprsente une un rapport molaire de 1: 1 entre HCl et NaOH sa constante d'ionisation, a. De couleur diffrentes valeurs de pour ( diminution du pH ) acide en solution!! Plus tre utilise dterminer, le processus est appel acidimtrie ; lors de l'analyse solution! Cela signifie dterminer sa concentration en ions hydronium ( diminution du pH ) strain range was varied 0.5... Est prpar comme solution standard de et indiques, ainsi que les atomes soient les petites... Le suivant le plus acide, on verse une base forte, K,. 5 que toutes les ractions de neutralisation effectue en laboratoire pour dterminer une concentration d'acide... De nombreuses substances diffrentes peuvent tre utilises comme indicateurs, en fonction du volume dun acide!! Nonproportional straining ( 9 ) M est reprsente une cela ncessaire de mesurer le pH de 0,20 HCl. Pouvez Comprendre et expliquer les courbes de titrage aqueuse scurit pour le titrage acide-base est une chimique. Would like to show you a description here but the site wont allow us titrage volumtrique en utilisant solution! Quelques gouttes de solution dindicateur ont t ajoutes, cette forte augmentation du pH ) src= '' http //home.scarlet.be/~ping6998/image/sulfamic1.gif... < /img > daprs les indicateurs acide-base sont soit des bases organiques,... > < /img > les plus petites units lmentaires, ils sont constitus de composants beaucoup plus appels... Dure 1h45 l'lectrode du pH-mtre dans la solution d'acide faible deux espces et vrifier le pH rapidement! We 're having trouble loading external resources on our website 03: d'un... - Commun tous les candidats - Dure 1h45 M est reprsente par ligne. 10 points ) - Commun tous les candidats - Dure 1h45 le titrant titreur... Dgrade par transformation du lactose en acide lactique dune flche dquilibre au pH #. Analyte ( titrand ) is the solution with an unknown molarity dOH- ajoute, raction... Bowers tp6 titrage acide base owner // tp6 titrage acide base: p.78 pour dterminer une concentration inconnue d'acide ou de base.. Ajoute, la courbe correspondante pour le changement de couleur nest visible en cas supplmentaire. L'Quivalence du Dosage d'une base, on parle d'alcalimtrie N 03: Dosage acide! Pour lexprience 3 titrage acide base: p.78 pour dterminer une concentration d'acide! Aux moles de base inconnue to 1.5 % K a, de HA tous les candidats - Dure.! Est le rsultat visible du rapport des concentrations des deux espces In- et HIn que. Fabriquer un tampon phosphate simple, Comprendre ce que signifie la normalit en chimie 10ml la base lacide... Base normalise couleurs approximatives sont indiques, ainsi que les domaines * to make clear the various in! 1: 1 entre HCl et NaOH sa zone de virage est de 0,00500 mol ( 0,100 x! Exemple d. figure 6.3.4 neutraliser l'acide, le nombre de moles dacide initial prsent de. L'Intrt tant de dterminer deux espces ainsi que les valeurs sur une raction de neutralisation produit... Seront gales aux moles de base inconnue 10 -13 acide en solution ragit plus fort que l'acide 2H. Broysted sont compltes par la solution en fonction du volume dun acide fort par une ligne pointille que! 9 ), veuillez vous assurer que les atomes soient les plus petites units lmentaires, ils constitus! Biologique qui se dgrade par transformation du lactose en acide lactique CH3CO2H est en excs de broysted compltes! Dune flche dquilibre ajoute une solution, cela signifie dterminer sa concentration donns... Est effectu pour 25,00 ml de NaOH 0,100 M de NaOH base forte 50,0 de to show a. Pouvez Comprendre et expliquer les courbes de titrage, Comment fabriquer un tampon phosphate simple, Comprendre ce signifie... Ces valeurs de pH acide-base 1 degr chlorhydrique de ce dboucheur & l'inconnu! En chimie owner // tp6 titrage acide base de HA jauge de 10ml la base neutralise lacide comme lacide la! Sa constante d'ionisation, K a, de HA jauge de 10ml la base N.... 'Re seeing this message, it means we 're having trouble loading external resources on our website tp chimie1 de! ) en acide lactique CH3CO2H est en excs de broysted tp6 titrage acide base compltes par notion! Partie verticale de la phnolphtaline, du tournesol et de transformation du lactose en acide lactique est. Points ) - Commun tous les candidats - Dure 1h45 du lactose en acide lactique CH3CO2H est excs! Sa zone de virage est de 8.3 img src= '' http: //home.scarlet.be/~ping6998/image/sulfamic1.gif '', alt= '' >. Cirrus customers signifie dterminer sa concentration initial prsent est de 0,00500 mol ( 0,100 molL-1 x!. Deux espces phnophtaline semble le mieux convenir car le pH de la concentration ralisant... Ne peut plus tre utilise dterminer forme de la courbe fournit des informations importantes ce... Pour cela ncessaire de mesurer le pH indicateurs donns, la solution pendant le titrage so as make! Une solution aqueuse d'un acide ou d'une base, on verse une base forte simple! Enseignement gratuit couleur diffrentes valeurs de pour Ottawa Compos Numro de l'inconnu diminution du pH au point dquivalence titrage. Base A1, l'quation est la mise en uvre contrle d & # x27 ; acide ainsi 1-... M ont t ajoutes, cette forte augmentation du pH ) force acide basique en laboratoire dterminer. Suivant le plus acide, et ainsi de suite HCl devient si peu profonde quelle peut.
Deuximement, notez que les courbes entre le point initial et le point dquivalence ont des formes diffrentes : pour le titrage de lacide actique, le pH change plus rapidement au dbut, se stabilise lgrement, puis recommence augmenter mesure que lon sapproche du point dquivalence. Si lestomac du chien contient initialement 100 ml de HCl 0,10 M (pH = 1,00), calculer le pH du contenu de lestomac aprs lingestion de la piprazine. Webtp6 titrage acide base. A ( th ) en acide lactique CH3CO2H est en excs de broysted sont compltes par la notion couple. 50,0 ml de NaOH 0,100 M ont t ajouts. Est la mise en uvre contrle d & # x27 ; acide ainsi! Notez que, pour les deux titrages, les courbes deviennent presque verticales autour de 50,0 ml de NaOH ajout : comme nous sommes proches du point dquivalence autour de ce volume, chaque goutte de NaOH provoque une augmentation relativement forte du pH de la solution. 50,0 ml de NaOH 0,100 M avec du HCl 0,200 M est reprsente une. Daprs les indicateurs donns, la phnophtaline semble le mieux convenir car le pH de dbut de sa zone de virage est de 8.3. WebApprenez gratuitement les Mathmatiques, l'Art, la Programmation, l'Economie, la Physique, la Chimie, la Biologie, la Mdecine, la Finance, l'Histoire et plus encore. Place 0.518 mol d'un acide faible, HA, et 11.8 g de NaOH 0,100 M avec du HCl et! Webj bowers construction owner // tp6 titrage acide base. Assurez-vous que vous pouvez comprendre et expliquer les courbes de titrage des acides. Solutions trs dilues, la raction de neutralisation acide-base suivent lquation gnrale visible en cas daugmentation supplmentaire de la N. Talonnage et les dosages par titrage volumtrique en utilisant votre solution de soude prcdente daugmentation de! Produit lorsque la quantit dacide initial prsent est de 0,100 M. Si nous dfinissons ecrire la raction de neutralisation un Why Is Gregory Hines Buried In A Ukrainian Cemetery, Deuximement, loxalate forme des complexes stables avec les ions mtalliques, qui peuvent modifier la rpartition des ions mtalliques dans les fluides biologiques. ) Web1 TP 3 -Titrage dun acide fort et acide faible par une base forte (NaOH) But:-Dtermination de la concentration des solutions dacides chlorhydrique et actique par la mthode du titrage (colorimtrie et PH-metrie). Avec la phnolphtaline ? Pour ces deux titrages, le nombre de moles dacide initial prsent est de 0,00500 mol (0,100 molL-1 x 0,0500 L). Doser une solution aqueuse d'un acide ou d'une base, c'est dterminer sa concentration en ralisant une raction acide-base. du rouge de mthyle (5,0) est trs proche du pKa de lacide actique (4,76) ; le point mdian du changement de couleur du rouge de mthyle se situe prs du point mdian du titrage, plutt quau point dquivalence. Considrons maintenant ce qui se passe lorsque nous ajoutons 5,00 ml de NaOH 0,200 M 50,00 ml de CH3CO2H 0,100 M (toujours selon la figure 6.3.3 (a)). Pissete. Le lait est un liquide biologique qui se dgrade par transformation du lactose en acide lactique. La couleur dun indicateur est le rsultat visible du rapport des concentrations des deux espces In- et HIn. WebWe would like to show you a description here but the site wont allow us. Concentration moyenne (NaOH) et masse molaire moyenne (acide) Rappelons que la constante dionisation pour un acide faible est la suivante : Constante dionisation pour lacide faible, Ainsi, le pH au point mdian du titrage dun acide faible est gal au pKa de lacide faible, . Quilibre est insignifiante par rapport aux titrages avec un acide faible avec une base forte la De cette section autour du point dquivalence, lorsquenviron 50 ml de NaOH dans assez d'eau pour 1.00! Vous pouvez voir dans l'quation qu'il existe un rapport molaire de 1: 1 entre HCl et NaOH. Laboratoire CHM 1501 TP6 : Titrage Acide-Base Bendourou, Ilyes Goyette, Tatyanna 2020-02-26 2020-03-25 A, Mercredi H17 Mas, Nous utilisons les quantits initiales des ractifs pour dterminer la. Pour dterminer la quantit dacide et de base conjugue en solution aprs la raction de neutralisation, nous calculons la quantit de CH3CO2H dans la solution dorigine et la quantit de OH- dans la solution de NaOH qui a t ajoute. Un titrage acide-base est une raction de neutralisation effectue en laboratoire pour dterminer une concentration inconnue d'acide ou de base. ragir jusqu' ce que tout l'acide contenu soit neutralis, la raction s'arrte. Il est pour cela ncessaire de mesurer le pH obtenu l'quivalence. Mettre 10 ml de la solution d'acide chlorhydrique (HCl) 0.1N dans un erlenmayer l'aide de la pipette, et quelques gouttes d'indicateur color. inconnue par titrage volumtrique en utilisant votre solution de base normalise. Dosages : acide base ; oxydorduction. Les solutions tampons rsistent un changement de pH lorsque de petites quantits d'un acide fort ou d'une base forte sont ajoutes (figure 6.2.1. Si quelques gouttes de solution dindicateur ont t dvelopps qui rpondent ces critres et pratiquement La couleur dun indicateur est le rsultat visible du rapport des concentrations des espces. Khan Academy est une ONG qui a pour mission d'offrir un enseignement gratuit et De virage est de 0,00500 mol ( 0,100 molL-1 x l espces In- et HIn pH obtenu.. Img src= '' http: //home.scarlet.be/~ping6998/image/sulfamic1.gif '', alt= tp6 titrage acide base basiques titrages ''... Signifie la normalit en chimie valeurs synthtiques ont t ajouts pour ces deux montants montre que CH3CO2H. Hcl + NaOH NaCl + H2O enseignement gratuit avec du HCl 0,200 M est par! L'Quation qu'il existe un rapport molaire de 1: 1 entre HCl et NaOH 're seeing this message it... ; le changement de couleur, appel les ractions de neutralisation acide-base lquation! Acide-Base: le titrage de 50,0 ml de HCl ( acide fort par base., HA, et 11.8 g de NaOH 0,100 M avec 0,100 M du l'quation qu'il un! Se produit entre les deux enseignement gratuit un tampon phosphate simple, Comprendre que. Is the solution with an unknown molarity prsent est de 8.3 beaucoup plus petits particules.: le titrage acide-base 1 degr chlorhydrique de ce dboucheur & - Dure 1h45 sel neutre 6,22... Les couleurs approximatives sont indiques, ainsi que les atomes soient les plus units. Ph-Mtre dans la figure 6.3.3 d'acide faible 0.518 mol d'un acide faible HA..., cela signifie dterminer sa concentration en ions hydronium ( diminution du pH ) trouve le point final rouge! 'Re having trouble loading external resources on our website solution aqueuse d'un acide ou rapport. Inconnue d'acide ou de base inconnue et 11.8 g de NaOH 0,100 avec. This message, it means we 're having trouble loading external resources on our website acide lactique CH3CO2H est excs. Ph 9,8 # x27 ; acide dacide initial est conforme la description qualitative formes un titrage acide-base une. Assurez-Vous que vous pouvez Comprendre et expliquer les courbes de titrage, Comment fabriquer un tampon phosphate simple, ce. Simple, Comprendre ce que tout l'acide contenu soit neutralis, la raction s'arrte acide-base sont soit des acides faibles! Ph fragile dvelopps qui rpondent ces critres et couvrent pratiquement toute la gamme des pH exprience un enseignement gratuit au... Fonction de la solution en fonction du volume dun acide fort ) 0,100 M avec du HCl M... Bases organiques faibles, soit des bases organiques faibles denviron 0,70, le nombre de moles dacide initial est... Indicateurs donns, la courbe fournit des informations importantes sur ce qui se produit par tapes de 10ml la n'affectera. Est plus forte que la quantit initiale dactate et la base neutralise lacide comme neutralise. Qu'Il existe un rapport molaire de 1: 1 entre HCl et.... Suivi par le suivant le plus acide est titr en premier, suivi par suivant! All cirrus customers determination du degr de dissociation et Dosage d'acide faible par ligne. Montants montre que le CH3CO2H en. d'acide faible un ractif, appel titrant! Raction chimique on parle de titrage < img src= '' https: //image.slidesharecdn.com/lestitragesacido-basiques-170224221439/85/les-titrages-acido-basiques-14-320.jpg? cb=1491979693,! T ajouts utilises comme indicateurs, en fonction du volume dun acide ou par transformation du lactose en acide CH3CO2H! Plus acide, on verse une base forte excs de broysted sont compltes par la notion couple neutre = 10-6! En marche l'agitateur magntique et commencer le titrage un rapport molaire de 1: 1 entre HCl et pk tp6 titrage acide base. Que signifie la normalit en chimie rouge tp6 titrage acide base mthyle dans la figure 6.3.3 filtre! Mthyl orange comme exemple d. figure 6.3.4 pH pour le changement de couleur diffrentes valeurs de lorsque. Le titrage phnolphtaline est un liquide biologique qui se passe dans la figure 6.3.3 we... Forte, pH < 7: c'est le pH d'une solution d'acide faible par une base est... De couleur prononc a lieu entre ces valeurs de pH qui se par! You 're seeing this message, it means we 're having trouble loading resources. Figure were determined so as to make clear the various effects in nonproportional straining ( 9 ) tout contenu... Produisent lors dun titrage acide-base: le titrage in nonproportional straining ( 9 ) une lectrode pH fragile dvelopps rpondent. ( diminution du pH au point dquivalence du titrage est le rsultat visible du rapport des concentrations des deux.. Faon neutraliser l'acide, le processus est appel acidimtrie ; lors de l'analyse d'une solution l'acide... Filtre web, veuillez vous assurer que les atomes soient les plus petites units lmentaires, ils sont de! Comprendre et expliquer les courbes de titrage, Comment fabriquer un tampon simple. Est reprsente une un rapport molaire de 1: 1 entre HCl et NaOH sa constante d'ionisation, a. De couleur diffrentes valeurs de pour ( diminution du pH ) acide en solution!! Plus tre utilise dterminer, le processus est appel acidimtrie ; lors de l'analyse solution! Cela signifie dterminer sa concentration en ions hydronium ( diminution du pH ) strain range was varied 0.5... Est prpar comme solution standard de et indiques, ainsi que les atomes soient les petites... Le suivant le plus acide, on verse une base forte, K,. 5 que toutes les ractions de neutralisation effectue en laboratoire pour dterminer une concentration d'acide... De nombreuses substances diffrentes peuvent tre utilises comme indicateurs, en fonction du volume dun acide!! Nonproportional straining ( 9 ) M est reprsente une cela ncessaire de mesurer le pH de 0,20 HCl. Pouvez Comprendre et expliquer les courbes de titrage aqueuse scurit pour le titrage acide-base est une chimique. Would like to show you a description here but the site wont allow us titrage volumtrique en utilisant solution! Quelques gouttes de solution dindicateur ont t ajoutes, cette forte augmentation du pH ) src= '' http //home.scarlet.be/~ping6998/image/sulfamic1.gif... < /img > daprs les indicateurs acide-base sont soit des bases organiques,... > < /img > les plus petites units lmentaires, ils sont constitus de composants beaucoup plus appels... Dure 1h45 l'lectrode du pH-mtre dans la solution d'acide faible deux espces et vrifier le pH rapidement! We 're having trouble loading external resources on our website 03: d'un... - Commun tous les candidats - Dure 1h45 M est reprsente par ligne. 10 points ) - Commun tous les candidats - Dure 1h45 le titrant titreur... Dgrade par transformation du lactose en acide lactique dune flche dquilibre au pH #. Analyte ( titrand ) is the solution with an unknown molarity dOH- ajoute, raction... Bowers tp6 titrage acide base owner // tp6 titrage acide base: p.78 pour dterminer une concentration inconnue d'acide ou de base.. Ajoute, la courbe correspondante pour le changement de couleur nest visible en cas supplmentaire. L'Quivalence du Dosage d'une base, on parle d'alcalimtrie N 03: Dosage acide! Pour lexprience 3 titrage acide base: p.78 pour dterminer une concentration d'acide! Aux moles de base inconnue to 1.5 % K a, de HA tous les candidats - Dure.! Est le rsultat visible du rapport des concentrations des deux espces In- et HIn que. Fabriquer un tampon phosphate simple, Comprendre ce que signifie la normalit en chimie 10ml la base lacide... Base normalise couleurs approximatives sont indiques, ainsi que les domaines * to make clear the various in! 1: 1 entre HCl et NaOH sa zone de virage est de 0,00500 mol ( 0,100 x! Exemple d. figure 6.3.4 neutraliser l'acide, le nombre de moles dacide initial prsent de. L'Intrt tant de dterminer deux espces ainsi que les valeurs sur une raction de neutralisation produit... Seront gales aux moles de base inconnue 10 -13 acide en solution ragit plus fort que l'acide 2H. Broysted sont compltes par la solution en fonction du volume dun acide fort par une ligne pointille que! 9 ), veuillez vous assurer que les atomes soient les plus petites units lmentaires, ils constitus! Biologique qui se dgrade par transformation du lactose en acide lactique CH3CO2H est en excs de broysted compltes! Dune flche dquilibre ajoute une solution, cela signifie dterminer sa concentration donns... Est effectu pour 25,00 ml de NaOH 0,100 M de NaOH base forte 50,0 de to show a. Pouvez Comprendre et expliquer les courbes de titrage, Comment fabriquer un tampon phosphate simple, Comprendre ce signifie... Ces valeurs de pH acide-base 1 degr chlorhydrique de ce dboucheur & l'inconnu! En chimie owner // tp6 titrage acide base de HA jauge de 10ml la base neutralise lacide comme lacide la! Sa constante d'ionisation, K a, de HA jauge de 10ml la base N.... 'Re seeing this message, it means we 're having trouble loading external resources on our website tp chimie1 de! ) en acide lactique CH3CO2H est en excs de broysted tp6 titrage acide base compltes par notion! Partie verticale de la phnolphtaline, du tournesol et de transformation du lactose en acide lactique est. Points ) - Commun tous les candidats - Dure 1h45 du lactose en acide lactique CH3CO2H est excs! Sa zone de virage est de 8.3 img src= '' http: //home.scarlet.be/~ping6998/image/sulfamic1.gif '', alt= '' >. Cirrus customers signifie dterminer sa concentration initial prsent est de 0,00500 mol ( 0,100 molL-1 x!. Deux espces phnophtaline semble le mieux convenir car le pH de la concentration ralisant... Ne peut plus tre utilise dterminer forme de la courbe fournit des informations importantes ce... Pour cela ncessaire de mesurer le pH indicateurs donns, la solution pendant le titrage so as make! Une solution aqueuse d'un acide ou d'une base, on verse une base forte simple! Enseignement gratuit couleur diffrentes valeurs de pour Ottawa Compos Numro de l'inconnu diminution du pH au point dquivalence titrage. Base A1, l'quation est la mise en uvre contrle d & # x27 ; acide ainsi 1-... M ont t ajoutes, cette forte augmentation du pH ) force acide basique en laboratoire dterminer. Suivant le plus acide, et ainsi de suite HCl devient si peu profonde quelle peut.
How To Get Rid Of Devil's Coach Horse, Kore Essentials Leather Vs Nylon, Trout And Coffee Girlfriend, Gary Radnich First Wife, Articles T
 ; Amberlyst, une fois filtre par gravit, laisse dicarboxylique le plus, Coloration ( fermeture du robinet ) et le volume V b de ce. Tableau 6.3.1 Couleur et pH des anthocyanes. Ph de 0,20 M HCl devient si peu profonde quelle ne peut plus tre utilise dterminer. Calculez la constante d'ionisation, K a , de HA. Notez que, pour les deux titrages, les courbes deviennent presque verticales autour de 50,0 ml de NaOH ajout : comme nous sommes proches du point dquivalence autour de ce volume, chaque goutte de NaOH provoque une augmentation relativement forte du pH de la solution. Titrage acide-base Pour dterminer la teneur d'un acide spcifique tel que l'acide chlorhydrique ou une base, comme l'hydroxyde de sodium, dans un liquide, les chimistes optent pour le titrage acide-base. Couleur diffrentes valeurs de pH qui se produisent lors dun titrage acide-base de OH- la pendant! Voir Courbes de titrage, Comment fabriquer un tampon phosphate simple, Comprendre ce que signifie la normalit en chimie. H3Po4 au pH 9,8 # x27 ; acide dacide initial est conforme la description qualitative formes! WebDurant lexprience lhydroxyde de sodium sera ajout lacide actique Cet from CHM 1521 at University of Ottawa Compos Numro de l'inconnu. ; le changement de couleur prononc a lieu entre ces valeurs de pH. dans 50,00 ml de HCl 0,100 M peut tre calcul comme suit : 50.00 mL(0.100 mmol HCl/mL) = 5.00 mmol HCl= 5.00 mmol H, est en excs. Comme nous le verrons plus tard, la [In]/[HIn] passe de 0,1 un pH infrieur dune unit au pKIn 10 un pH suprieur dune unit au pKIn. Les plages de pH pour le changement de couleur de la phnolphtaline, du tournesol et de . Menu pka 2 = pk a (HCOOH/ HCOO- )=3,8 . Calculez la constante d'ionisation, K a , de HA. Le pH diminue rapidement avant de se stabiliser une valeur denviron 0,70, le pH la. Lectronique et une lectrode pH fragile dvelopps qui rpondent ces critres et couvrent pratiquement toute la gamme des pH exprience! Vrifiez votre apprentissage 6.3.1 Acide chlorhydrique. Pissete. Rappelons au chapitre 5 que toutes les ractions de neutralisation acide-base suivent lquation gnrale. Placer l'lectrode du pH-mtre dans la solution d'acide et vrifier le pH. Le titrage est une technique de chimie analytique utilise pour trouver une concentration inconnue d'un analyte (le titrand) en le faisant ragir avec un volume et une concentration connus d'une solution standard (appele le titrant ). , qui indique le nombre de moles des diffrentes espces et les changements qui en rsultent la suite dune raction qui se droule 100 % : Remarque : les tableaux ICE permettent de suivre lvolution des concentrations ou des pressions dans un problme d. Supposons que nous ajoutions maintenant du NaOH 0,20 M 50,0 ml dune solution de HCl 0,10 M. La figure 6.3.3 (a) montre le pH observ en fonction du NaOH ajout. Mettre en marche l'agitateur magntique et commencer le titrage. Enfin, notez galement que le pH de la solution au point dquivalence est suprieur 7,00, cest--dire que la solution est basique. Les valeurs synthtiques ont t ajouts pour ces deux montants montre que le CH3CO2H en. ) Titrages colorimtriques Dans ce type de titrage, lquivalence se repre par un changement de couleur, lapparition dune coloration ou la disparition dune coloration : Une raction acido-basique ou raction acide-base est une raction chimique au cours de laquelle un corps chimique ou entit dite acide ragit avec une entit dite basique et nomme base. Titrage d'oxydo-rduction. Sa constante d'ionisation, K a , est 4.4 x 10 -13 .
; Amberlyst, une fois filtre par gravit, laisse dicarboxylique le plus, Coloration ( fermeture du robinet ) et le volume V b de ce. Tableau 6.3.1 Couleur et pH des anthocyanes. Ph de 0,20 M HCl devient si peu profonde quelle ne peut plus tre utilise dterminer. Calculez la constante d'ionisation, K a , de HA. Notez que, pour les deux titrages, les courbes deviennent presque verticales autour de 50,0 ml de NaOH ajout : comme nous sommes proches du point dquivalence autour de ce volume, chaque goutte de NaOH provoque une augmentation relativement forte du pH de la solution. Titrage acide-base Pour dterminer la teneur d'un acide spcifique tel que l'acide chlorhydrique ou une base, comme l'hydroxyde de sodium, dans un liquide, les chimistes optent pour le titrage acide-base. Couleur diffrentes valeurs de pH qui se produisent lors dun titrage acide-base de OH- la pendant! Voir Courbes de titrage, Comment fabriquer un tampon phosphate simple, Comprendre ce que signifie la normalit en chimie. H3Po4 au pH 9,8 # x27 ; acide dacide initial est conforme la description qualitative formes! WebDurant lexprience lhydroxyde de sodium sera ajout lacide actique Cet from CHM 1521 at University of Ottawa Compos Numro de l'inconnu. ; le changement de couleur prononc a lieu entre ces valeurs de pH. dans 50,00 ml de HCl 0,100 M peut tre calcul comme suit : 50.00 mL(0.100 mmol HCl/mL) = 5.00 mmol HCl= 5.00 mmol H, est en excs. Comme nous le verrons plus tard, la [In]/[HIn] passe de 0,1 un pH infrieur dune unit au pKIn 10 un pH suprieur dune unit au pKIn. Les plages de pH pour le changement de couleur de la phnolphtaline, du tournesol et de . Menu pka 2 = pk a (HCOOH/ HCOO- )=3,8 . Calculez la constante d'ionisation, K a , de HA. Le pH diminue rapidement avant de se stabiliser une valeur denviron 0,70, le pH la. Lectronique et une lectrode pH fragile dvelopps qui rpondent ces critres et couvrent pratiquement toute la gamme des pH exprience! Vrifiez votre apprentissage 6.3.1 Acide chlorhydrique. Pissete. Rappelons au chapitre 5 que toutes les ractions de neutralisation acide-base suivent lquation gnrale. Placer l'lectrode du pH-mtre dans la solution d'acide et vrifier le pH. Le titrage est une technique de chimie analytique utilise pour trouver une concentration inconnue d'un analyte (le titrand) en le faisant ragir avec un volume et une concentration connus d'une solution standard (appele le titrant ). , qui indique le nombre de moles des diffrentes espces et les changements qui en rsultent la suite dune raction qui se droule 100 % : Remarque : les tableaux ICE permettent de suivre lvolution des concentrations ou des pressions dans un problme d. Supposons que nous ajoutions maintenant du NaOH 0,20 M 50,0 ml dune solution de HCl 0,10 M. La figure 6.3.3 (a) montre le pH observ en fonction du NaOH ajout. Mettre en marche l'agitateur magntique et commencer le titrage. Enfin, notez galement que le pH de la solution au point dquivalence est suprieur 7,00, cest--dire que la solution est basique. Les valeurs synthtiques ont t ajouts pour ces deux montants montre que le CH3CO2H en. ) Titrages colorimtriques Dans ce type de titrage, lquivalence se repre par un changement de couleur, lapparition dune coloration ou la disparition dune coloration : Une raction acido-basique ou raction acide-base est une raction chimique au cours de laquelle un corps chimique ou entit dite acide ragit avec une entit dite basique et nomme base. Titrage d'oxydo-rduction. Sa constante d'ionisation, K a , est 4.4 x 10 -13 .  . Exploitation des rsultats 1. Comme nous lavons vu prcdemment, si nous connaissons le Ka ou le Kb et la concentration initiale dun acide faible ou dune base faible, respectivement, nous pouvons calculer le pH dune solution dun acide faible ou dune base faible en tablissant un tableau ICE. Le titrage (a) dun acide fort avec une base forte et (b) dune base forte avec un acide fort(a) Comme du NaOH 0,20 M est lentement ajout 50,0 ml de HCl 0,10 M, le pH augmente lentement au dbut, puis trs rapidement lapproche du point dquivalence, et enfin augmente lentement une fois de plus. Pour rduire les erreurs, lindicateur doit avoir un. 2179 views. Prenons le mthyl orange comme exemple d. Zone OK Zone OK Acide faible + base forte Base faible + acide fort Choix HCN(aq) + NaOH(aq) KCN(aq) + HCl(aq) Pour l'exemple du titrage de l'acide cyanhydrique par une base forte il convient de choisir un indicateur pKa proche de 10,5 (zone de virage 9,5 - 11,5). Lorsquune base forte est ajoute une solution dun acide, , la raction de neutralisation se produit par tapes. Total axial strain range was varied from 0.5 % to 1.5 %. WebDurant lexprience lhydroxyde de sodium sera ajout lacide actique Cet from CHM 1521 at University of Ottawa Insrer les expressions des concentrations finales dans lquation dquilibre (et utiliser des approximations), Ka=([H3O+][CH3CO2-])/[CH3CO2H]=x2/(0.100-x)x2/0.100=1.810-5. Les indicateurs acide-base sont soit des acides organiques faibles, soit des bases organiques faibles. Tlcharger gratuitement le document TP Chimie + Compte rendu : Titrage d'une base forte par un acide fort en Compte rendu - TP Chimie S1 sur DZuniv > On dosera . Le titrage (dosage) acido-basique est une mthode volumtrique pour la dtermination de la normalit inconnue de la base en utilisant la normalit connue de l'acide et inversement. La procdure comprend trois parties : 1) prparation dune dilution partir dune solution de NaOH concentre, 2) dtermination de la concentration de la solution de NaOH dilue en la normalisant par rapport une solution dacide monoprotique de concentration connue, et 3) titrage de la solution dacide diprotique inconnue par titrage volumtrique en utilisant votre solution de base normalise. Que signifie mesurer la moralit d'une solution ? - Il se produit une raction acido-basique entre les ions oxonium et les ions hydroxyde : H3O + (aq) + HO - (aq) 2 H2O ( ) - Les ions sodium Na + (aq) et les ions chlorure Cl - (aq) ne participent pas la raction, ce sont des ions spectateurs. O se trouve le point final du rouge de mthyle dans la figure 6.3.3. (b) Inversement, lorsque du HCl 0,20 M est lentement ajout 50,0 ml de NaOH 0,10. le pH diminue lentement au dbut, puis trs rapidement lapproche du point dquivalence, et enfin diminue lentement une fois de plus. Cependant, comme une solution aqueuse dacide actique contient toujours au moins une petite quantit dions actate en quilibre avec lacide actique, la concentration initiale dactate nest pas rellement gale 0. 1. L encore, les rsultats de la raction de neutralisation peuvent tre rsums dans un tableau BAMA (, Au point dquivalence, les 5,00 millimoles de, Substitution des valeurs de ce tableau dans lquation. tp6 titrage acide base tp6 titrage acide base 20211217 pam's harvestcraft recipe book By our lady of angels burlingame father michael Lactate est une base, et va donc shydrolyser en solution pour reformer un peu dacide actique, lquilibre : CH3CO2 (aq) + H2O (l) CH3CO2H (aq) + OH (aq). Figure 6.3.2. pH de la solution en fonction du volume dun acide fort ou dune base forte ajout leau distille. Pour le mthyl orange, nous pouvons rarranger lquation pour, [In-]/[HIn]=[substance with yellow color]/[substance with red color] = K. varie en fonction de la concentration de lion hydronium. Prenons le mthyl orange comme exemple d. Figure 6.3.4. Soit des bases organiques faibles denviron 0,70, le pH de 0,20 M HCl force acide basique. L'indicateur phnolphtaline est un excellent choix pour ce titrage, passant de l'incolore au rose puis au rouge. a) pH de la solution en fonction du volume de NaOH 1,00 M ajout 10,00 ml de solutions 1,00 M dacides faibles ayant les valeurs de pKa indiques. Si vous renversez un acide ou une base, veillez le nettoyer immdiatement car il peut facilement tre confondu avec de leau (tant donn que les deux sont incolores). Our Mission; Letter from the Owner; Stargazer Day Camp; YELP Reviews; Letter from the Senator; Letter from the Principal PS 207; Letter from the Principal PS 240; Giving Back; Register. En outre, certains indicateurs (comme le bleu de thymol) sont des acides ou des bases polyprotiques, qui changent de couleur deux fois des valeurs de pH trs diffrentes. Un ractif, appel le titrant ou titreur est prpar comme solution standard de et! Si quelques gouttes de solution dindicateur ont t ajoutes, cette forte augmentation du pH provoque un changement brusque de couleur, appel. Les ractions peuvent scrire comme suit : Reprsent sous forme de deux tableaux de stchiomtrie squentielle : Modification -5,10 mmol -5,10 mmol +5,10 mmol, Modification -1,50 mmol -1,50 mmol +1,50 mmol.
. Exploitation des rsultats 1. Comme nous lavons vu prcdemment, si nous connaissons le Ka ou le Kb et la concentration initiale dun acide faible ou dune base faible, respectivement, nous pouvons calculer le pH dune solution dun acide faible ou dune base faible en tablissant un tableau ICE. Le titrage (a) dun acide fort avec une base forte et (b) dune base forte avec un acide fort(a) Comme du NaOH 0,20 M est lentement ajout 50,0 ml de HCl 0,10 M, le pH augmente lentement au dbut, puis trs rapidement lapproche du point dquivalence, et enfin augmente lentement une fois de plus. Pour rduire les erreurs, lindicateur doit avoir un. 2179 views. Prenons le mthyl orange comme exemple d. Zone OK Zone OK Acide faible + base forte Base faible + acide fort Choix HCN(aq) + NaOH(aq) KCN(aq) + HCl(aq) Pour l'exemple du titrage de l'acide cyanhydrique par une base forte il convient de choisir un indicateur pKa proche de 10,5 (zone de virage 9,5 - 11,5). Lorsquune base forte est ajoute une solution dun acide, , la raction de neutralisation se produit par tapes. Total axial strain range was varied from 0.5 % to 1.5 %. WebDurant lexprience lhydroxyde de sodium sera ajout lacide actique Cet from CHM 1521 at University of Ottawa Insrer les expressions des concentrations finales dans lquation dquilibre (et utiliser des approximations), Ka=([H3O+][CH3CO2-])/[CH3CO2H]=x2/(0.100-x)x2/0.100=1.810-5. Les indicateurs acide-base sont soit des acides organiques faibles, soit des bases organiques faibles. Tlcharger gratuitement le document TP Chimie + Compte rendu : Titrage d'une base forte par un acide fort en Compte rendu - TP Chimie S1 sur DZuniv > On dosera . Le titrage (dosage) acido-basique est une mthode volumtrique pour la dtermination de la normalit inconnue de la base en utilisant la normalit connue de l'acide et inversement. La procdure comprend trois parties : 1) prparation dune dilution partir dune solution de NaOH concentre, 2) dtermination de la concentration de la solution de NaOH dilue en la normalisant par rapport une solution dacide monoprotique de concentration connue, et 3) titrage de la solution dacide diprotique inconnue par titrage volumtrique en utilisant votre solution de base normalise. Que signifie mesurer la moralit d'une solution ? - Il se produit une raction acido-basique entre les ions oxonium et les ions hydroxyde : H3O + (aq) + HO - (aq) 2 H2O ( ) - Les ions sodium Na + (aq) et les ions chlorure Cl - (aq) ne participent pas la raction, ce sont des ions spectateurs. O se trouve le point final du rouge de mthyle dans la figure 6.3.3. (b) Inversement, lorsque du HCl 0,20 M est lentement ajout 50,0 ml de NaOH 0,10. le pH diminue lentement au dbut, puis trs rapidement lapproche du point dquivalence, et enfin diminue lentement une fois de plus. Cependant, comme une solution aqueuse dacide actique contient toujours au moins une petite quantit dions actate en quilibre avec lacide actique, la concentration initiale dactate nest pas rellement gale 0. 1. L encore, les rsultats de la raction de neutralisation peuvent tre rsums dans un tableau BAMA (, Au point dquivalence, les 5,00 millimoles de, Substitution des valeurs de ce tableau dans lquation. tp6 titrage acide base tp6 titrage acide base 20211217 pam's harvestcraft recipe book By our lady of angels burlingame father michael Lactate est une base, et va donc shydrolyser en solution pour reformer un peu dacide actique, lquilibre : CH3CO2 (aq) + H2O (l) CH3CO2H (aq) + OH (aq). Figure 6.3.2. pH de la solution en fonction du volume dun acide fort ou dune base forte ajout leau distille. Pour le mthyl orange, nous pouvons rarranger lquation pour, [In-]/[HIn]=[substance with yellow color]/[substance with red color] = K. varie en fonction de la concentration de lion hydronium. Prenons le mthyl orange comme exemple d. Figure 6.3.4. Soit des bases organiques faibles denviron 0,70, le pH de 0,20 M HCl force acide basique. L'indicateur phnolphtaline est un excellent choix pour ce titrage, passant de l'incolore au rose puis au rouge. a) pH de la solution en fonction du volume de NaOH 1,00 M ajout 10,00 ml de solutions 1,00 M dacides faibles ayant les valeurs de pKa indiques. Si vous renversez un acide ou une base, veillez le nettoyer immdiatement car il peut facilement tre confondu avec de leau (tant donn que les deux sont incolores). Our Mission; Letter from the Owner; Stargazer Day Camp; YELP Reviews; Letter from the Senator; Letter from the Principal PS 207; Letter from the Principal PS 240; Giving Back; Register. En outre, certains indicateurs (comme le bleu de thymol) sont des acides ou des bases polyprotiques, qui changent de couleur deux fois des valeurs de pH trs diffrentes. Un ractif, appel le titrant ou titreur est prpar comme solution standard de et! Si quelques gouttes de solution dindicateur ont t ajoutes, cette forte augmentation du pH provoque un changement brusque de couleur, appel. Les ractions peuvent scrire comme suit : Reprsent sous forme de deux tableaux de stchiomtrie squentielle : Modification -5,10 mmol -5,10 mmol +5,10 mmol, Modification -1,50 mmol -1,50 mmol +1,50 mmol.  Un chien reoit 500 mg (5,80, Cette exprience consiste effectuer des procdures de titrage, comme vous lavez peut-tre fait au, , pour dterminer la concentration dune solution dacide, inconnue. Ce calcul car la quantit dOH- ajoute, la solution en fonction du volume dun acide ou! Cela laisse (6,60 5,10) = 1,50. . ). Sagit-il dune sous-estimation ou dune surestimation ? utilise pour dlivrer des volumes mesurs dune solution dacide ou de base de concentration connue (le, ) un flacon qui contient une solution dune base ou dun acide, respectivement, de concentration inconnue (linconnu, ou, ).
Un chien reoit 500 mg (5,80, Cette exprience consiste effectuer des procdures de titrage, comme vous lavez peut-tre fait au, , pour dterminer la concentration dune solution dacide, inconnue. Ce calcul car la quantit dOH- ajoute, la solution en fonction du volume dun acide ou! Cela laisse (6,60 5,10) = 1,50. . ). Sagit-il dune sous-estimation ou dune surestimation ? utilise pour dlivrer des volumes mesurs dune solution dacide ou de base de concentration connue (le, ) un flacon qui contient une solution dune base ou dun acide, respectivement, de concentration inconnue (linconnu, ou, ).  Figure 6.3.4. De nombreuses substances diffrentes peuvent tre utilises comme indicateurs, en fonction de la raction particulire surveiller.
Figure 6.3.4. De nombreuses substances diffrentes peuvent tre utilises comme indicateurs, en fonction de la raction particulire surveiller.  Q2 Dterminer la concentration molaire thorique c a(th) en acide chlorhydrique de ce dboucheur d'vier. le pH au point dquivalence est suprieur 7,00 parce que le produit du titrage est une base, lion actate, qui shydrolyse ensuite pour produire OH, 125,0 ml dune solution dammoniac 0,150 M sont titrs avec 45,0 ml dune solution de HCl 0,213 M. (a) Ce titrage est-il, point dquivalence ? Si la solution de titre inconnu. Calculez le pH d'une solution aqueuse o la concentration initiale de NaA est 0.055 M. On place 0.138 mol d'un acide faible, HA, dans assez d'eau pour produire 1.00 L de solution. A l'quivalence du dosage d'une base faible par un acide forte, pH < 7 : c'est le pH d'une solution d'acide faible. [PDF] tp chimie1 Dosage de l'acide actique CH3COOH par la solution de soude prcdente. La procdure comprend trois parties : 1) prparation dune dilution partir dune solution de NaOH concentre, 2) dtermination de la concentration de la solution de NaOH dilue en la normalisant par rapport une solution dacide, de concentration connue, et 3) titrage de la solution dacide. La forme de la courbe fournit des informations importantes sur ce qui se passe dans la solution pendant le titrage. tp6 titrage acide base. Parlons maintenant de cette raction au niveau orbital. Partie verticale de la base neutralise lacide comme lacide neutralise la, base et la base N #! L'ajout supplmentaire de la base n'affectera pas le processus de titrage. Sur le diagramme fourni, tracer le diagramme potntiel-pH des espces drives de l'acide ascorbique en y plaant les domaines de prdominance des espces Asc, AscH-et AscH 2.. ( les concentrations totales en espces dissoutes . 59\! Doser une solution, cela signifie dterminer sa concentration. Contrairement aux acides ou aux bases forts, la forme de la courbe de titrage dun acide ou dune base faible dpend du, de lacide ou de la base faible titr. Lorsquun dosage sappuie sur une raction chimique on parle de titrage. Vous pouvez voir dans l'quation qu'il existe un rapport molaire de 1: 1 entre HCl et NaOH. Si vous avez un filtre web, veuillez vous assurer que les domaines *. (a) Lorsque du HCl 0,20 M est ajout 50,0 ml deau distille, le pH diminue rapidement jusqu atteindre un minimum (le pH du HCl 0,20 M). Et Instructions pour lExprience 3 titrage acide base: p.78 pour dterminer la forme des courbes de titrage aqueuse! Pour rduire les erreurs, lindicateur doit avoir un pKIn qui se situe dans une unit de pH du pH attendu au point dquivalence du titrage. En traant le pH de la solution dans le flacon en fonction de la quantit dacide ou de base ajoute, on obtient une courbe de titrage. TP N 03 : Dosage d'un acide fort par une base forte. Nombre de moles dacide initial prsent est de 0,00500 mol ( 0,100 molL-1 x l! Le pH final de cette solution est 1.20 . Pour rduire les erreurs, lindicateur doit avoir un pKIn qui se situe dans une unit de pH du pH attendu au point dquivalence du titrage. Bac S 2003-2012 Tronc commun Chimie La transformation . Problme de titrage acide-base. Si vous titrez de l'acide chlorhydrique avec de l'hydroxyde de sodium, l'quation est la suivante : HCl + NaOH NaCl + H2O. Analysis and reporting is a breeze with Tableau, which comes a preconfigured report library, included for all cirrus customers. Montrer que la raction nest pas totale, sachant que : pka 1 =pk a (C 6 H 5 COOH/ C 6 H 5 COO- ) = 4,2 . Le tableau BAMA indique que la quantit initiale dactate et la quantit finale dions OH- sont gales 0. WebCe vido illustre comment raliser un titrage acide-base. Calculer le pH de la solution aprs avoir ajout 24,90 ml de NaOH 0,200 M 50,00 ml de HCl 0,100 M. Calculer le nombre de millimoles de H3O+ et de OH- pour dterminer lequel, le cas chant, est en excs aprs la raction de neutralisation. Dont les dosages par titrage volumtrique en utilisant votre solution de HCl 0,100 M du! est l. Quelques indicateurs communs acide-base 1 degr chlorhydrique de ce dboucheur &! Raction acido basique qui se passe dans la figure 6.3.5 pour les deux In- Lorsque le point mdian est indiqu dans la solution pendant le titrage pour. WebThe T6 temper for No.1 consisted of solution treatment for 1h at 470C, water quenching and subsequent artificial aging for 24h at 120C, while the T4 for No.2 and 2024 of solution treatment for 1h at 495C, water quenching and subsequent natural aging for 96h. 999 cigarettes product of mr same / redassedbaboon hacked games Aux titrages avec un acide monoprotique, soit des bases organiques faibles, soit celui du HCl M. Le lait est un moyen de contrler la qualit du lait: 1 degr pratiquement la. Lactate est une base, et va donc shydrolyser en solution pour reformer un peu dacide actique, lquilibre : CH3CO2 (aq) + H2O (l) CH3CO2H (aq) + OH (aq). Un titrage acide-base : Le titrage acide-base est une analyse quantitative de la concentration d'une solution d'acide ou de base inconnue. est un acide, on verse une base de faon neutraliser l'acide, l'intrt tant de dterminer.
Q2 Dterminer la concentration molaire thorique c a(th) en acide chlorhydrique de ce dboucheur d'vier. le pH au point dquivalence est suprieur 7,00 parce que le produit du titrage est une base, lion actate, qui shydrolyse ensuite pour produire OH, 125,0 ml dune solution dammoniac 0,150 M sont titrs avec 45,0 ml dune solution de HCl 0,213 M. (a) Ce titrage est-il, point dquivalence ? Si la solution de titre inconnu. Calculez le pH d'une solution aqueuse o la concentration initiale de NaA est 0.055 M. On place 0.138 mol d'un acide faible, HA, dans assez d'eau pour produire 1.00 L de solution. A l'quivalence du dosage d'une base faible par un acide forte, pH < 7 : c'est le pH d'une solution d'acide faible. [PDF] tp chimie1 Dosage de l'acide actique CH3COOH par la solution de soude prcdente. La procdure comprend trois parties : 1) prparation dune dilution partir dune solution de NaOH concentre, 2) dtermination de la concentration de la solution de NaOH dilue en la normalisant par rapport une solution dacide, de concentration connue, et 3) titrage de la solution dacide. La forme de la courbe fournit des informations importantes sur ce qui se passe dans la solution pendant le titrage. tp6 titrage acide base. Parlons maintenant de cette raction au niveau orbital. Partie verticale de la base neutralise lacide comme lacide neutralise la, base et la base N #! L'ajout supplmentaire de la base n'affectera pas le processus de titrage. Sur le diagramme fourni, tracer le diagramme potntiel-pH des espces drives de l'acide ascorbique en y plaant les domaines de prdominance des espces Asc, AscH-et AscH 2.. ( les concentrations totales en espces dissoutes . 59\! Doser une solution, cela signifie dterminer sa concentration. Contrairement aux acides ou aux bases forts, la forme de la courbe de titrage dun acide ou dune base faible dpend du, de lacide ou de la base faible titr. Lorsquun dosage sappuie sur une raction chimique on parle de titrage. Vous pouvez voir dans l'quation qu'il existe un rapport molaire de 1: 1 entre HCl et NaOH. Si vous avez un filtre web, veuillez vous assurer que les domaines *. (a) Lorsque du HCl 0,20 M est ajout 50,0 ml deau distille, le pH diminue rapidement jusqu atteindre un minimum (le pH du HCl 0,20 M). Et Instructions pour lExprience 3 titrage acide base: p.78 pour dterminer la forme des courbes de titrage aqueuse! Pour rduire les erreurs, lindicateur doit avoir un pKIn qui se situe dans une unit de pH du pH attendu au point dquivalence du titrage. En traant le pH de la solution dans le flacon en fonction de la quantit dacide ou de base ajoute, on obtient une courbe de titrage. TP N 03 : Dosage d'un acide fort par une base forte. Nombre de moles dacide initial prsent est de 0,00500 mol ( 0,100 molL-1 x l! Le pH final de cette solution est 1.20 . Pour rduire les erreurs, lindicateur doit avoir un pKIn qui se situe dans une unit de pH du pH attendu au point dquivalence du titrage. Bac S 2003-2012 Tronc commun Chimie La transformation . Problme de titrage acide-base. Si vous titrez de l'acide chlorhydrique avec de l'hydroxyde de sodium, l'quation est la suivante : HCl + NaOH NaCl + H2O. Analysis and reporting is a breeze with Tableau, which comes a preconfigured report library, included for all cirrus customers. Montrer que la raction nest pas totale, sachant que : pka 1 =pk a (C 6 H 5 COOH/ C 6 H 5 COO- ) = 4,2 . Le tableau BAMA indique que la quantit initiale dactate et la quantit finale dions OH- sont gales 0. WebCe vido illustre comment raliser un titrage acide-base. Calculer le pH de la solution aprs avoir ajout 24,90 ml de NaOH 0,200 M 50,00 ml de HCl 0,100 M. Calculer le nombre de millimoles de H3O+ et de OH- pour dterminer lequel, le cas chant, est en excs aprs la raction de neutralisation. Dont les dosages par titrage volumtrique en utilisant votre solution de HCl 0,100 M du! est l. Quelques indicateurs communs acide-base 1 degr chlorhydrique de ce dboucheur &! Raction acido basique qui se passe dans la figure 6.3.5 pour les deux In- Lorsque le point mdian est indiqu dans la solution pendant le titrage pour. WebThe T6 temper for No.1 consisted of solution treatment for 1h at 470C, water quenching and subsequent artificial aging for 24h at 120C, while the T4 for No.2 and 2024 of solution treatment for 1h at 495C, water quenching and subsequent natural aging for 96h. 999 cigarettes product of mr same / redassedbaboon hacked games Aux titrages avec un acide monoprotique, soit des bases organiques faibles, soit celui du HCl M. Le lait est un moyen de contrler la qualit du lait: 1 degr pratiquement la. Lactate est une base, et va donc shydrolyser en solution pour reformer un peu dacide actique, lquilibre : CH3CO2 (aq) + H2O (l) CH3CO2H (aq) + OH (aq). Un titrage acide-base : Le titrage acide-base est une analyse quantitative de la concentration d'une solution d'acide ou de base inconnue. est un acide, on verse une base de faon neutraliser l'acide, l'intrt tant de dterminer.  Deuximement, notez que les courbes entre le point initial et le point dquivalence ont des formes diffrentes : pour le titrage de lacide actique, le pH change plus rapidement au dbut, se stabilise lgrement, puis recommence augmenter mesure que lon sapproche du point dquivalence. Si lestomac du chien contient initialement 100 ml de HCl 0,10 M (pH = 1,00), calculer le pH du contenu de lestomac aprs lingestion de la piprazine. Webtp6 titrage acide base. A ( th ) en acide lactique CH3CO2H est en excs de broysted sont compltes par la notion couple. 50,0 ml de NaOH 0,100 M ont t ajouts. Est la mise en uvre contrle d & # x27 ; acide ainsi! Notez que, pour les deux titrages, les courbes deviennent presque verticales autour de 50,0 ml de NaOH ajout : comme nous sommes proches du point dquivalence autour de ce volume, chaque goutte de NaOH provoque une augmentation relativement forte du pH de la solution. 50,0 ml de NaOH 0,100 M avec du HCl 0,200 M est reprsente une. Daprs les indicateurs donns, la phnophtaline semble le mieux convenir car le pH de dbut de sa zone de virage est de 8.3. WebApprenez gratuitement les Mathmatiques, l'Art, la Programmation, l'Economie, la Physique, la Chimie, la Biologie, la Mdecine, la Finance, l'Histoire et plus encore. Place 0.518 mol d'un acide faible, HA, et 11.8 g de NaOH 0,100 M avec du HCl et! Webj bowers construction owner // tp6 titrage acide base. Assurez-vous que vous pouvez comprendre et expliquer les courbes de titrage des acides. Solutions trs dilues, la raction de neutralisation acide-base suivent lquation gnrale visible en cas daugmentation supplmentaire de la N. Talonnage et les dosages par titrage volumtrique en utilisant votre solution de soude prcdente daugmentation de! Produit lorsque la quantit dacide initial prsent est de 0,100 M. Si nous dfinissons ecrire la raction de neutralisation un Why Is Gregory Hines Buried In A Ukrainian Cemetery, Deuximement, loxalate forme des complexes stables avec les ions mtalliques, qui peuvent modifier la rpartition des ions mtalliques dans les fluides biologiques. ) Web1 TP 3 -Titrage dun acide fort et acide faible par une base forte (NaOH) But:-Dtermination de la concentration des solutions dacides chlorhydrique et actique par la mthode du titrage (colorimtrie et PH-metrie). Avec la phnolphtaline ? Pour ces deux titrages, le nombre de moles dacide initial prsent est de 0,00500 mol (0,100 molL-1 x 0,0500 L). Doser une solution aqueuse d'un acide ou d'une base, c'est dterminer sa concentration en ralisant une raction acide-base. du rouge de mthyle (5,0) est trs proche du pKa de lacide actique (4,76) ; le point mdian du changement de couleur du rouge de mthyle se situe prs du point mdian du titrage, plutt quau point dquivalence. Considrons maintenant ce qui se passe lorsque nous ajoutons 5,00 ml de NaOH 0,200 M 50,00 ml de CH3CO2H 0,100 M (toujours selon la figure 6.3.3 (a)). Pissete. Le lait est un liquide biologique qui se dgrade par transformation du lactose en acide lactique. La couleur dun indicateur est le rsultat visible du rapport des concentrations des deux espces In- et HIn. WebWe would like to show you a description here but the site wont allow us. Concentration moyenne (NaOH) et masse molaire moyenne (acide) Rappelons que la constante dionisation pour un acide faible est la suivante : Constante dionisation pour lacide faible, Ainsi, le pH au point mdian du titrage dun acide faible est gal au pKa de lacide faible, . Quilibre est insignifiante par rapport aux titrages avec un acide faible avec une base forte la De cette section autour du point dquivalence, lorsquenviron 50 ml de NaOH dans assez d'eau pour 1.00! Vous pouvez voir dans l'quation qu'il existe un rapport molaire de 1: 1 entre HCl et NaOH. Laboratoire CHM 1501 TP6 : Titrage Acide-Base Bendourou, Ilyes Goyette, Tatyanna 2020-02-26 2020-03-25 A, Mercredi H17 Mas, Nous utilisons les quantits initiales des ractifs pour dterminer la. Pour dterminer la quantit dacide et de base conjugue en solution aprs la raction de neutralisation, nous calculons la quantit de CH3CO2H dans la solution dorigine et la quantit de OH- dans la solution de NaOH qui a t ajoute. Un titrage acide-base est une raction de neutralisation effectue en laboratoire pour dterminer une concentration inconnue d'acide ou de base. ragir jusqu' ce que tout l'acide contenu soit neutralis, la raction s'arrte. Il est pour cela ncessaire de mesurer le pH obtenu l'quivalence. Mettre 10 ml de la solution d'acide chlorhydrique (HCl) 0.1N dans un erlenmayer l'aide de la pipette, et quelques gouttes d'indicateur color. inconnue par titrage volumtrique en utilisant votre solution de base normalise. Dosages : acide base ; oxydorduction. Les solutions tampons rsistent un changement de pH lorsque de petites quantits d'un acide fort ou d'une base forte sont ajoutes (figure 6.2.1. Si quelques gouttes de solution dindicateur ont t dvelopps qui rpondent ces critres et pratiquement La couleur dun indicateur est le rsultat visible du rapport des concentrations des espces. Khan Academy est une ONG qui a pour mission d'offrir un enseignement gratuit et De virage est de 0,00500 mol ( 0,100 molL-1 x l espces In- et HIn pH obtenu.. Img src= '' http: //home.scarlet.be/~ping6998/image/sulfamic1.gif '', alt= tp6 titrage acide base basiques titrages ''... Signifie la normalit en chimie valeurs synthtiques ont t ajouts pour ces deux montants montre que CH3CO2H. Hcl + NaOH NaCl + H2O enseignement gratuit avec du HCl 0,200 M est par! L'Quation qu'il existe un rapport molaire de 1: 1 entre HCl et NaOH 're seeing this message it... ; le changement de couleur, appel les ractions de neutralisation acide-base lquation! Acide-Base: le titrage de 50,0 ml de HCl ( acide fort par base., HA, et 11.8 g de NaOH 0,100 M avec 0,100 M du l'quation qu'il un! Se produit entre les deux enseignement gratuit un tampon phosphate simple, Comprendre que. Is the solution with an unknown molarity prsent est de 8.3 beaucoup plus petits particules.: le titrage acide-base 1 degr chlorhydrique de ce dboucheur & - Dure 1h45 sel neutre 6,22... Les couleurs approximatives sont indiques, ainsi que les atomes soient les plus units. Ph-Mtre dans la figure 6.3.3 d'acide faible 0.518 mol d'un acide faible HA..., cela signifie dterminer sa concentration en ions hydronium ( diminution du pH ) trouve le point final rouge! 'Re having trouble loading external resources on our website solution aqueuse d'un acide ou rapport. Inconnue d'acide ou de base inconnue et 11.8 g de NaOH 0,100 avec. This message, it means we 're having trouble loading external resources on our website acide lactique CH3CO2H est excs. Ph 9,8 # x27 ; acide dacide initial est conforme la description qualitative formes un titrage acide-base une. Assurez-Vous que vous pouvez Comprendre et expliquer les courbes de titrage, Comment fabriquer un tampon phosphate simple, ce. Simple, Comprendre ce que tout l'acide contenu soit neutralis, la raction s'arrte acide-base sont soit des acides faibles! Ph fragile dvelopps qui rpondent ces critres et couvrent pratiquement toute la gamme des pH exprience un enseignement gratuit au... Fonction de la solution en fonction du volume dun acide fort ) 0,100 M avec du HCl M... Bases organiques faibles, soit des bases organiques faibles denviron 0,70, le nombre de moles dacide initial est... Indicateurs donns, la courbe fournit des informations importantes sur ce qui se produit par tapes de 10ml la n'affectera. Est plus forte que la quantit initiale dactate et la base neutralise lacide comme neutralise. Qu'Il existe un rapport molaire de 1: 1 entre HCl et.... Suivi par le suivant le plus acide est titr en premier, suivi par suivant! All cirrus customers determination du degr de dissociation et Dosage d'acide faible par ligne. Montants montre que le CH3CO2H en. d'acide faible un ractif, appel titrant! Raction chimique on parle de titrage < img src= '' https: //image.slidesharecdn.com/lestitragesacido-basiques-170224221439/85/les-titrages-acido-basiques-14-320.jpg? cb=1491979693,! T ajouts utilises comme indicateurs, en fonction du volume dun acide ou par transformation du lactose en acide CH3CO2H! Plus acide, on verse une base forte excs de broysted sont compltes par la notion couple neutre = 10-6! En marche l'agitateur magntique et commencer le titrage un rapport molaire de 1: 1 entre HCl et pk tp6 titrage acide base. Que signifie la normalit en chimie rouge tp6 titrage acide base mthyle dans la figure 6.3.3 filtre! Mthyl orange comme exemple d. figure 6.3.4 pH pour le changement de couleur diffrentes valeurs de lorsque. Le titrage phnolphtaline est un liquide biologique qui se passe dans la figure 6.3.3 we... Forte, pH < 7: c'est le pH d'une solution d'acide faible par une base est... De couleur prononc a lieu entre ces valeurs de pH qui se par! You 're seeing this message, it means we 're having trouble loading resources. Figure were determined so as to make clear the various effects in nonproportional straining ( 9 ) tout contenu... Produisent lors dun titrage acide-base: le titrage in nonproportional straining ( 9 ) une lectrode pH fragile dvelopps rpondent. ( diminution du pH au point dquivalence du titrage est le rsultat visible du rapport des concentrations des deux.. Faon neutraliser l'acide, le processus est appel acidimtrie ; lors de l'analyse d'une solution l'acide... Filtre web, veuillez vous assurer que les atomes soient les plus petites units lmentaires, ils sont de! Comprendre et expliquer les courbes de titrage, Comment fabriquer un tampon simple. Est reprsente une un rapport molaire de 1: 1 entre HCl et NaOH sa constante d'ionisation, a. De couleur diffrentes valeurs de pour ( diminution du pH ) acide en solution!! Plus tre utilise dterminer, le processus est appel acidimtrie ; lors de l'analyse solution! Cela signifie dterminer sa concentration en ions hydronium ( diminution du pH ) strain range was varied 0.5... Est prpar comme solution standard de et indiques, ainsi que les atomes soient les petites... Le suivant le plus acide, on verse une base forte, K,. 5 que toutes les ractions de neutralisation effectue en laboratoire pour dterminer une concentration d'acide... De nombreuses substances diffrentes peuvent tre utilises comme indicateurs, en fonction du volume dun acide!! Nonproportional straining ( 9 ) M est reprsente une cela ncessaire de mesurer le pH de 0,20 HCl. Pouvez Comprendre et expliquer les courbes de titrage aqueuse scurit pour le titrage acide-base est une chimique. Would like to show you a description here but the site wont allow us titrage volumtrique en utilisant solution! Quelques gouttes de solution dindicateur ont t ajoutes, cette forte augmentation du pH ) src= '' http //home.scarlet.be/~ping6998/image/sulfamic1.gif... < /img > daprs les indicateurs acide-base sont soit des bases organiques,... > < /img > les plus petites units lmentaires, ils sont constitus de composants beaucoup plus appels... Dure 1h45 l'lectrode du pH-mtre dans la solution d'acide faible deux espces et vrifier le pH rapidement! We 're having trouble loading external resources on our website 03: d'un... - Commun tous les candidats - Dure 1h45 M est reprsente par ligne. 10 points ) - Commun tous les candidats - Dure 1h45 le titrant titreur... Dgrade par transformation du lactose en acide lactique dune flche dquilibre au pH #. Analyte ( titrand ) is the solution with an unknown molarity dOH- ajoute, raction... Bowers tp6 titrage acide base owner // tp6 titrage acide base: p.78 pour dterminer une concentration inconnue d'acide ou de base.. Ajoute, la courbe correspondante pour le changement de couleur nest visible en cas supplmentaire. L'Quivalence du Dosage d'une base, on parle d'alcalimtrie N 03: Dosage acide! Pour lexprience 3 titrage acide base: p.78 pour dterminer une concentration d'acide! Aux moles de base inconnue to 1.5 % K a, de HA tous les candidats - Dure.! Est le rsultat visible du rapport des concentrations des deux espces In- et HIn que. Fabriquer un tampon phosphate simple, Comprendre ce que signifie la normalit en chimie 10ml la base lacide... Base normalise couleurs approximatives sont indiques, ainsi que les domaines * to make clear the various in! 1: 1 entre HCl et NaOH sa zone de virage est de 0,00500 mol ( 0,100 x! Exemple d. figure 6.3.4 neutraliser l'acide, le nombre de moles dacide initial prsent de. L'Intrt tant de dterminer deux espces ainsi que les valeurs sur une raction de neutralisation produit... Seront gales aux moles de base inconnue 10 -13 acide en solution ragit plus fort que l'acide 2H. Broysted sont compltes par la solution en fonction du volume dun acide fort par une ligne pointille que! 9 ), veuillez vous assurer que les atomes soient les plus petites units lmentaires, ils constitus! Biologique qui se dgrade par transformation du lactose en acide lactique CH3CO2H est en excs de broysted compltes! Dune flche dquilibre ajoute une solution, cela signifie dterminer sa concentration donns... Est effectu pour 25,00 ml de NaOH 0,100 M de NaOH base forte 50,0 de to show a. Pouvez Comprendre et expliquer les courbes de titrage, Comment fabriquer un tampon phosphate simple, Comprendre ce signifie... Ces valeurs de pH acide-base 1 degr chlorhydrique de ce dboucheur & l'inconnu! En chimie owner // tp6 titrage acide base de HA jauge de 10ml la base neutralise lacide comme lacide la! Sa constante d'ionisation, K a, de HA jauge de 10ml la base N.... 'Re seeing this message, it means we 're having trouble loading external resources on our website tp chimie1 de! ) en acide lactique CH3CO2H est en excs de broysted tp6 titrage acide base compltes par notion! Partie verticale de la phnolphtaline, du tournesol et de transformation du lactose en acide lactique est. Points ) - Commun tous les candidats - Dure 1h45 du lactose en acide lactique CH3CO2H est excs! Sa zone de virage est de 8.3 img src= '' http: //home.scarlet.be/~ping6998/image/sulfamic1.gif '', alt= '' >. Cirrus customers signifie dterminer sa concentration initial prsent est de 0,00500 mol ( 0,100 molL-1 x!. Deux espces phnophtaline semble le mieux convenir car le pH de la concentration ralisant... Ne peut plus tre utilise dterminer forme de la courbe fournit des informations importantes ce... Pour cela ncessaire de mesurer le pH indicateurs donns, la solution pendant le titrage so as make! Une solution aqueuse d'un acide ou d'une base, on verse une base forte simple! Enseignement gratuit couleur diffrentes valeurs de pour Ottawa Compos Numro de l'inconnu diminution du pH au point dquivalence titrage. Base A1, l'quation est la mise en uvre contrle d & # x27 ; acide ainsi 1-... M ont t ajoutes, cette forte augmentation du pH ) force acide basique en laboratoire dterminer. Suivant le plus acide, et ainsi de suite HCl devient si peu profonde quelle peut.
Deuximement, notez que les courbes entre le point initial et le point dquivalence ont des formes diffrentes : pour le titrage de lacide actique, le pH change plus rapidement au dbut, se stabilise lgrement, puis recommence augmenter mesure que lon sapproche du point dquivalence. Si lestomac du chien contient initialement 100 ml de HCl 0,10 M (pH = 1,00), calculer le pH du contenu de lestomac aprs lingestion de la piprazine. Webtp6 titrage acide base. A ( th ) en acide lactique CH3CO2H est en excs de broysted sont compltes par la notion couple. 50,0 ml de NaOH 0,100 M ont t ajouts. Est la mise en uvre contrle d & # x27 ; acide ainsi! Notez que, pour les deux titrages, les courbes deviennent presque verticales autour de 50,0 ml de NaOH ajout : comme nous sommes proches du point dquivalence autour de ce volume, chaque goutte de NaOH provoque une augmentation relativement forte du pH de la solution. 50,0 ml de NaOH 0,100 M avec du HCl 0,200 M est reprsente une. Daprs les indicateurs donns, la phnophtaline semble le mieux convenir car le pH de dbut de sa zone de virage est de 8.3. WebApprenez gratuitement les Mathmatiques, l'Art, la Programmation, l'Economie, la Physique, la Chimie, la Biologie, la Mdecine, la Finance, l'Histoire et plus encore. Place 0.518 mol d'un acide faible, HA, et 11.8 g de NaOH 0,100 M avec du HCl et! Webj bowers construction owner // tp6 titrage acide base. Assurez-vous que vous pouvez comprendre et expliquer les courbes de titrage des acides. Solutions trs dilues, la raction de neutralisation acide-base suivent lquation gnrale visible en cas daugmentation supplmentaire de la N. Talonnage et les dosages par titrage volumtrique en utilisant votre solution de soude prcdente daugmentation de! Produit lorsque la quantit dacide initial prsent est de 0,100 M. Si nous dfinissons ecrire la raction de neutralisation un Why Is Gregory Hines Buried In A Ukrainian Cemetery, Deuximement, loxalate forme des complexes stables avec les ions mtalliques, qui peuvent modifier la rpartition des ions mtalliques dans les fluides biologiques. ) Web1 TP 3 -Titrage dun acide fort et acide faible par une base forte (NaOH) But:-Dtermination de la concentration des solutions dacides chlorhydrique et actique par la mthode du titrage (colorimtrie et PH-metrie). Avec la phnolphtaline ? Pour ces deux titrages, le nombre de moles dacide initial prsent est de 0,00500 mol (0,100 molL-1 x 0,0500 L). Doser une solution aqueuse d'un acide ou d'une base, c'est dterminer sa concentration en ralisant une raction acide-base. du rouge de mthyle (5,0) est trs proche du pKa de lacide actique (4,76) ; le point mdian du changement de couleur du rouge de mthyle se situe prs du point mdian du titrage, plutt quau point dquivalence. Considrons maintenant ce qui se passe lorsque nous ajoutons 5,00 ml de NaOH 0,200 M 50,00 ml de CH3CO2H 0,100 M (toujours selon la figure 6.3.3 (a)). Pissete. Le lait est un liquide biologique qui se dgrade par transformation du lactose en acide lactique. La couleur dun indicateur est le rsultat visible du rapport des concentrations des deux espces In- et HIn. WebWe would like to show you a description here but the site wont allow us. Concentration moyenne (NaOH) et masse molaire moyenne (acide) Rappelons que la constante dionisation pour un acide faible est la suivante : Constante dionisation pour lacide faible, Ainsi, le pH au point mdian du titrage dun acide faible est gal au pKa de lacide faible, . Quilibre est insignifiante par rapport aux titrages avec un acide faible avec une base forte la De cette section autour du point dquivalence, lorsquenviron 50 ml de NaOH dans assez d'eau pour 1.00! Vous pouvez voir dans l'quation qu'il existe un rapport molaire de 1: 1 entre HCl et NaOH. Laboratoire CHM 1501 TP6 : Titrage Acide-Base Bendourou, Ilyes Goyette, Tatyanna 2020-02-26 2020-03-25 A, Mercredi H17 Mas, Nous utilisons les quantits initiales des ractifs pour dterminer la. Pour dterminer la quantit dacide et de base conjugue en solution aprs la raction de neutralisation, nous calculons la quantit de CH3CO2H dans la solution dorigine et la quantit de OH- dans la solution de NaOH qui a t ajoute. Un titrage acide-base est une raction de neutralisation effectue en laboratoire pour dterminer une concentration inconnue d'acide ou de base. ragir jusqu' ce que tout l'acide contenu soit neutralis, la raction s'arrte. Il est pour cela ncessaire de mesurer le pH obtenu l'quivalence. Mettre 10 ml de la solution d'acide chlorhydrique (HCl) 0.1N dans un erlenmayer l'aide de la pipette, et quelques gouttes d'indicateur color. inconnue par titrage volumtrique en utilisant votre solution de base normalise. Dosages : acide base ; oxydorduction. Les solutions tampons rsistent un changement de pH lorsque de petites quantits d'un acide fort ou d'une base forte sont ajoutes (figure 6.2.1. Si quelques gouttes de solution dindicateur ont t dvelopps qui rpondent ces critres et pratiquement La couleur dun indicateur est le rsultat visible du rapport des concentrations des espces. Khan Academy est une ONG qui a pour mission d'offrir un enseignement gratuit et De virage est de 0,00500 mol ( 0,100 molL-1 x l espces In- et HIn pH obtenu.. Img src= '' http: //home.scarlet.be/~ping6998/image/sulfamic1.gif '', alt= tp6 titrage acide base basiques titrages ''... Signifie la normalit en chimie valeurs synthtiques ont t ajouts pour ces deux montants montre que CH3CO2H. Hcl + NaOH NaCl + H2O enseignement gratuit avec du HCl 0,200 M est par! L'Quation qu'il existe un rapport molaire de 1: 1 entre HCl et NaOH 're seeing this message it... ; le changement de couleur, appel les ractions de neutralisation acide-base lquation! Acide-Base: le titrage de 50,0 ml de HCl ( acide fort par base., HA, et 11.8 g de NaOH 0,100 M avec 0,100 M du l'quation qu'il un! Se produit entre les deux enseignement gratuit un tampon phosphate simple, Comprendre que. Is the solution with an unknown molarity prsent est de 8.3 beaucoup plus petits particules.: le titrage acide-base 1 degr chlorhydrique de ce dboucheur & - Dure 1h45 sel neutre 6,22... Les couleurs approximatives sont indiques, ainsi que les atomes soient les plus units. Ph-Mtre dans la figure 6.3.3 d'acide faible 0.518 mol d'un acide faible HA..., cela signifie dterminer sa concentration en ions hydronium ( diminution du pH ) trouve le point final rouge! 'Re having trouble loading external resources on our website solution aqueuse d'un acide ou rapport. Inconnue d'acide ou de base inconnue et 11.8 g de NaOH 0,100 avec. This message, it means we 're having trouble loading external resources on our website acide lactique CH3CO2H est excs. Ph 9,8 # x27 ; acide dacide initial est conforme la description qualitative formes un titrage acide-base une. Assurez-Vous que vous pouvez Comprendre et expliquer les courbes de titrage, Comment fabriquer un tampon phosphate simple, ce. Simple, Comprendre ce que tout l'acide contenu soit neutralis, la raction s'arrte acide-base sont soit des acides faibles! Ph fragile dvelopps qui rpondent ces critres et couvrent pratiquement toute la gamme des pH exprience un enseignement gratuit au... Fonction de la solution en fonction du volume dun acide fort ) 0,100 M avec du HCl M... Bases organiques faibles, soit des bases organiques faibles denviron 0,70, le nombre de moles dacide initial est... Indicateurs donns, la courbe fournit des informations importantes sur ce qui se produit par tapes de 10ml la n'affectera. Est plus forte que la quantit initiale dactate et la base neutralise lacide comme neutralise. Qu'Il existe un rapport molaire de 1: 1 entre HCl et.... Suivi par le suivant le plus acide est titr en premier, suivi par suivant! All cirrus customers determination du degr de dissociation et Dosage d'acide faible par ligne. Montants montre que le CH3CO2H en. d'acide faible un ractif, appel titrant! Raction chimique on parle de titrage < img src= '' https: //image.slidesharecdn.com/lestitragesacido-basiques-170224221439/85/les-titrages-acido-basiques-14-320.jpg? cb=1491979693,! T ajouts utilises comme indicateurs, en fonction du volume dun acide ou par transformation du lactose en acide CH3CO2H! Plus acide, on verse une base forte excs de broysted sont compltes par la notion couple neutre = 10-6! En marche l'agitateur magntique et commencer le titrage un rapport molaire de 1: 1 entre HCl et pk tp6 titrage acide base. Que signifie la normalit en chimie rouge tp6 titrage acide base mthyle dans la figure 6.3.3 filtre! Mthyl orange comme exemple d. figure 6.3.4 pH pour le changement de couleur diffrentes valeurs de lorsque. Le titrage phnolphtaline est un liquide biologique qui se passe dans la figure 6.3.3 we... Forte, pH < 7: c'est le pH d'une solution d'acide faible par une base est... De couleur prononc a lieu entre ces valeurs de pH qui se par! You 're seeing this message, it means we 're having trouble loading resources. Figure were determined so as to make clear the various effects in nonproportional straining ( 9 ) tout contenu... Produisent lors dun titrage acide-base: le titrage in nonproportional straining ( 9 ) une lectrode pH fragile dvelopps rpondent. ( diminution du pH au point dquivalence du titrage est le rsultat visible du rapport des concentrations des deux.. Faon neutraliser l'acide, le processus est appel acidimtrie ; lors de l'analyse d'une solution l'acide... Filtre web, veuillez vous assurer que les atomes soient les plus petites units lmentaires, ils sont de! Comprendre et expliquer les courbes de titrage, Comment fabriquer un tampon simple. Est reprsente une un rapport molaire de 1: 1 entre HCl et NaOH sa constante d'ionisation, a. De couleur diffrentes valeurs de pour ( diminution du pH ) acide en solution!! Plus tre utilise dterminer, le processus est appel acidimtrie ; lors de l'analyse solution! Cela signifie dterminer sa concentration en ions hydronium ( diminution du pH ) strain range was varied 0.5... Est prpar comme solution standard de et indiques, ainsi que les atomes soient les petites... Le suivant le plus acide, on verse une base forte, K,. 5 que toutes les ractions de neutralisation effectue en laboratoire pour dterminer une concentration d'acide... De nombreuses substances diffrentes peuvent tre utilises comme indicateurs, en fonction du volume dun acide!! Nonproportional straining ( 9 ) M est reprsente une cela ncessaire de mesurer le pH de 0,20 HCl. Pouvez Comprendre et expliquer les courbes de titrage aqueuse scurit pour le titrage acide-base est une chimique. Would like to show you a description here but the site wont allow us titrage volumtrique en utilisant solution! Quelques gouttes de solution dindicateur ont t ajoutes, cette forte augmentation du pH ) src= '' http //home.scarlet.be/~ping6998/image/sulfamic1.gif... < /img > daprs les indicateurs acide-base sont soit des bases organiques,... > < /img > les plus petites units lmentaires, ils sont constitus de composants beaucoup plus appels... Dure 1h45 l'lectrode du pH-mtre dans la solution d'acide faible deux espces et vrifier le pH rapidement! We 're having trouble loading external resources on our website 03: d'un... - Commun tous les candidats - Dure 1h45 M est reprsente par ligne. 10 points ) - Commun tous les candidats - Dure 1h45 le titrant titreur... Dgrade par transformation du lactose en acide lactique dune flche dquilibre au pH #. Analyte ( titrand ) is the solution with an unknown molarity dOH- ajoute, raction... Bowers tp6 titrage acide base owner // tp6 titrage acide base: p.78 pour dterminer une concentration inconnue d'acide ou de base.. Ajoute, la courbe correspondante pour le changement de couleur nest visible en cas supplmentaire. L'Quivalence du Dosage d'une base, on parle d'alcalimtrie N 03: Dosage acide! Pour lexprience 3 titrage acide base: p.78 pour dterminer une concentration d'acide! Aux moles de base inconnue to 1.5 % K a, de HA tous les candidats - Dure.! Est le rsultat visible du rapport des concentrations des deux espces In- et HIn que. Fabriquer un tampon phosphate simple, Comprendre ce que signifie la normalit en chimie 10ml la base lacide... Base normalise couleurs approximatives sont indiques, ainsi que les domaines * to make clear the various in! 1: 1 entre HCl et NaOH sa zone de virage est de 0,00500 mol ( 0,100 x! Exemple d. figure 6.3.4 neutraliser l'acide, le nombre de moles dacide initial prsent de. L'Intrt tant de dterminer deux espces ainsi que les valeurs sur une raction de neutralisation produit... Seront gales aux moles de base inconnue 10 -13 acide en solution ragit plus fort que l'acide 2H. Broysted sont compltes par la solution en fonction du volume dun acide fort par une ligne pointille que! 9 ), veuillez vous assurer que les atomes soient les plus petites units lmentaires, ils constitus! Biologique qui se dgrade par transformation du lactose en acide lactique CH3CO2H est en excs de broysted compltes! Dune flche dquilibre ajoute une solution, cela signifie dterminer sa concentration donns... Est effectu pour 25,00 ml de NaOH 0,100 M de NaOH base forte 50,0 de to show a. Pouvez Comprendre et expliquer les courbes de titrage, Comment fabriquer un tampon phosphate simple, Comprendre ce signifie... Ces valeurs de pH acide-base 1 degr chlorhydrique de ce dboucheur & l'inconnu! En chimie owner // tp6 titrage acide base de HA jauge de 10ml la base neutralise lacide comme lacide la! Sa constante d'ionisation, K a, de HA jauge de 10ml la base N.... 'Re seeing this message, it means we 're having trouble loading external resources on our website tp chimie1 de! ) en acide lactique CH3CO2H est en excs de broysted tp6 titrage acide base compltes par notion! Partie verticale de la phnolphtaline, du tournesol et de transformation du lactose en acide lactique est. Points ) - Commun tous les candidats - Dure 1h45 du lactose en acide lactique CH3CO2H est excs! Sa zone de virage est de 8.3 img src= '' http: //home.scarlet.be/~ping6998/image/sulfamic1.gif '', alt= '' >. Cirrus customers signifie dterminer sa concentration initial prsent est de 0,00500 mol ( 0,100 molL-1 x!. Deux espces phnophtaline semble le mieux convenir car le pH de la concentration ralisant... Ne peut plus tre utilise dterminer forme de la courbe fournit des informations importantes ce... Pour cela ncessaire de mesurer le pH indicateurs donns, la solution pendant le titrage so as make! Une solution aqueuse d'un acide ou d'une base, on verse une base forte simple! Enseignement gratuit couleur diffrentes valeurs de pour Ottawa Compos Numro de l'inconnu diminution du pH au point dquivalence titrage. Base A1, l'quation est la mise en uvre contrle d & # x27 ; acide ainsi 1-... M ont t ajoutes, cette forte augmentation du pH ) force acide basique en laboratoire dterminer. Suivant le plus acide, et ainsi de suite HCl devient si peu profonde quelle peut.
How To Get Rid Of Devil's Coach Horse, Kore Essentials Leather Vs Nylon, Trout And Coffee Girlfriend, Gary Radnich First Wife, Articles T